
Technétium
Renseignements généraux
SOS Enfants a fait cette sélection Wikipedia aux côtés d'autres écoles des ressources . Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
| Technétium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
43 Tc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
métal gris brillant  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | technétium, Tc, 43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / t ɛ k n Je ʃ Je əm / tek- NEE -shee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 7, 5, ré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Kr ] 4d 5 5s 2 2, 8, 18, 13, 2 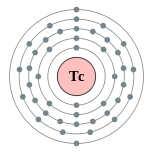 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prédiction | Dmitri Mendeleev (1871) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Carlo Perrier et Emilio Segrè (1937) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Carlo Perrier et Emilio Segrè (1937) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 11 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2430 K , 2157 ° C, 3915 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 4538 K, 4265 ° C, 7709 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 33,29 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 585,2 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,27 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur (extrapolée) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 7, 6, 5, 4, 3, 2, 1, -1, -3 (Fortement acide oxyde) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,9 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 702 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1470 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2850 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 136 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 147 ± 19 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | Paramagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 50,6 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 16 200 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-26-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de technétium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le technétium est l' élément chimique avec le numéro atomique 43 et le symbole Tc. Il est le plus faible numéro atomique élément sans isotopes stables ; toute forme de celui-ci est radioactifs. Presque tous technétium est produit synthétiquement et des quantités infimes sont dans la nature. Technétium naturelle se produit en tant que spontanée produits de fission dans le minerai d'uranium ou par capture de neutrons dans molybdène minerais. Les propriétés chimiques de ce gris argenté, cristallin de métal de transition sont intermédiaires entre le rhénium et le manganèse .
Beaucoup de propriétés de technétium ont été prédites par Dmitri Mendeleev avant que l'élément a été découvert. Mendeleïev a noté une lacune dans son tableau périodique et a donné l'élément à découvrir le nom provisoire ekamanganese (Em). En 1937, le technétium (en particulier la technétium-97 isotopes) est devenu le premier élément essentiellement artificielle à produire, d'où son nom (du grec τεχνητός, ce qui signifie «artificielle»).
Sa courte durée rayons gamma émettant isomérisation nucléaire technétium-99m est utilisé dans médecine nucléaire pour une grande variété de tests de diagnostic. Le technétium-99 est utilisé comme une source de rayons libre-gamma de particules bêta. À long terme isotopes de technetium sont produites commercialement sous-produits de fission de l'uranium-235 en réacteurs nucléaires et sont extraites de crayons de combustible nucléaire. Comme aucun isotope de technétium a une demi-vie plus de 4,2 millions d'années ( technétium-98), sa détection en 1952 dans les géantes rouges , qui sont des milliards d'années, contribué à soutenir la théorie que les étoiles peuvent produire des éléments plus lourds.
Histoire
Recherche pour l'élément 43
De les années 1860 grâce à 1871, les premières formes de la table périodique proposé par Dimitri Mendeleïev contenaient un écart entre le molybdène (élément 42) et de ruthénium (élément 44). En 1871, Mendeleïev prédit cet élément manquant serait occuper la place vide à la suite de manganèse et ont donc des propriétés chimiques semblables. Mendeleïev lui a donné le nom provisoire ekamanganese (de eka -, le sanscrit mot pour une, parce que l'élément prévu était un endroit bas de l'élément manganèse connu.)
De nombreux chercheurs début, à la fois avant et après la table périodique a été publié, étaient désireux d'être le premier à découvrir et nommer l'élément manquant; son emplacement dans le tableau suggéré qu'il devrait être plus facile à trouver que d'autres éléments non découvertes. Il a d'abord pensé avoir été trouvé en platine de minerais en 1828 et a été donné le nom polinium, mais se est avéré être impure iridium . Puis, en 1846, l'élément ilmenium a affirmé avoir été découvert, mais plus tard a été jugée impure niobium . Cette erreur a été répétée en 1847 avec la "découverte" de pelopium.
En 1877, le chimiste russe Serge Kern a rapporté la découverte de l'élément manquant dans le minerai de platine. Kern nommé ce qu'il pensait être le nouvel élément davyum (après le chimiste anglais Sir noté Humphry Davy ), mais il a finalement été déterminé à être un mélange de l'iridium , le rhodium et le fer . Un autre candidat, lucium, suivie en 1896, mais il a été déterminé que l'yttrium . Puis, en 1908, le chimiste japonais Masataka Ogawa a trouvé des preuves dans le minéral thorianite, dont il pensait indiqué la présence de l'élément 43. Ogawa nommé l'élément nipponium , après le Japon (qui est en japonais Nippon). En 2004, H. K Yoshihara utilisé "un dossier de spectre de rayons X de l'échantillon de nipponium de Ogawa de thorianite [qui] a été contenue dans une plaque photographique préservé par sa famille. Le spectre a été lu et a indiqué l'absence de l'élément 43 et le présence de l'élément 75 ( rhénium ) ".
Chimistes allemands Walter Noddack, Otto Berg, et Ida Tacke a signalé la découverte de l'élément 75 et l'élément 43 en 1925, et l'élément nommé 43 masurium (après Mazurie dans l'est Prusse, maintenant dans la Pologne , la région où la famille de Walter Noddack origine). Le groupe a bombardé colombite avec un faisceau d' électrons et en a déduit l'élément 43 était présent en examinant Diffraction des rayons X spectrogrammes. Le longueur d'onde des rayons X produits est liée au numéro atomique par une formule dérivée par Henry Moseley en 1913. L'équipe a remporté pour détecter un signal X-ray faible à une longueur d'onde produite par l'élément 43. expérimentateurs ultérieures pourraient ne pas reproduire la découverte, et il a été rejeté comme une erreur pour de nombreuses années. Pourtant, en 1933, une série d'articles sur la découverte d'éléments cité le nom de l'élément masurium 43. Débat existe toujours quant à savoir si l'équipe 1925 a effectivement fait découvrir l'élément 43.
Découverte officielle et l'histoire plus tard
Le découverte de l'élément 43 a finalement été confirmé dans une expérience Décembre 1936 à la Université de Palerme en Sicile menée par Carlo Perrier et Emilio Segrè. À la mi-1936, Segrè visité les États-Unis, d'abord Université de Columbia à New York, puis le Lawrence Berkeley National Laboratory en Californie. Il persuada inventeur cyclotron Ernest Lawrence de le laisser reprendre certaines parties de cyclotron rebut devenus radioactifs. Laurent lui a envoyé une feuille de molybdène qui avait fait partie du déflecteur dans le cyclotron.
Segrè enrôlé son collègue Perrier de tenter de prouver, grâce à la chimie comparative, que l'activité de molybdène était en effet d'un élément avec Z = 43. Ils ont réussi à isoler les isotopes technétium-95m et technétium-97. Université de fonctionnaires Palerme voulait nommer leur découverte "panormium", après la latine nom Palerme, Panormus. En 1947, l'élément 43 a été nommé d'après le grec mot τεχνητός, ce qui signifie «artificielle», puisque ce est le premier élément à être produite artificiellement. Segrè retourné à Berkeley et a rencontré Glenn T. Seaborg. Ils ont isolé le isotope métastable technétium-99m, qui est maintenant utilisé dans une dizaine de millions de procédures de diagnostic médical chaque année.
En 1952, l'astronome Paul W. Merrill en Californie détecté le signature spectrale du technétium (en particulier, la lumière avec longueur d'onde de 403,1 nm, 423,8 nm, 426,2 nm et 429,7 nm) à la lumière de de type S géantes rouges . Les étoiles étaient près de la fin de leur vie, mais sont riches en cet élément de courte durée, ce qui signifie réactions nucléaires dans les étoiles doivent être produire. Cette preuve a été utilisé pour renforcer la théorie non prouvée alors que les étoiles sont où nucléosynthèse des éléments plus lourds se produit. Plus récemment, ces observations ont fourni des preuves que les éléments ont été formés par capture de neutrons dans le s-processus.
Depuis sa découverte, il ya eu de nombreuses recherches dans les matériaux terrestres pour les sources naturelles de technétium. En 1962, le technétium-99 a été isolé et identifié en pechblende de la Congo belge en quantités extrêmement faibles (environ 0,2 ng / kg); elle est la source, il en produits de fission spontanée de l'uranium-238. Il est également prouvé que la Oklo naturelle réacteur de fission nucléaire produit des quantités importantes de technétium-99, qui a depuis décru en ruthénium-99.
Caractéristiques
Propriétés physiques
Le technétium radioactif est un gris argenté métallique avec une apparence similaire à celle de platine . Il est généralement obtenu sous forme d'une poudre grise. Le la structure cristalline du métal pur est hexagonal serrée. Technétium atomique a la caractéristique raies d'émission à ceux-ci longueurs d'onde de la lumière: 363,3 nm, 403,1 nm, 426,2 nm, 429,7 nm et 485,3 nm.
La forme métallique est légèrement paramagnétique, qui signifie que son dipôles magnétiques se alignent avec externe champs magnétiques, mais assumeront orientations aléatoires une fois que le champ est supprimé. Pur, métallique, monocristallin technétium devient un saisissez-II supraconducteur à des températures inférieures 7,46 K . En dessous de cette température, le technétium a une très haute profondeur de pénétration magnétique, le plus grand parmi les éléments en dehors de niobium .
Propriétés chimiques
Le technétium est placé dans le septième groupe de la classification périodique, entre le rhénium et le manganèse . Comme prévu par la loi périodique, ses propriétés chimiques sont donc intermédiaire entre ces deux éléments. Des deux, le technétium ressemble plus étroitement à du rhénium, en particulier dans son inertie chimique et sa tendance à former des liaisons covalentes. Contrairement manganèse, technétium ne fait pas facilement cations ( ions avec une charge nette positive). Commun les états d'oxydation du technetium comprennent 4, 5, et 7. Le technétium se dissout dans l'eau régale, l'acide nitrique , et concentré acide sulfurique , mais il ne est pas soluble dans l'acide chlorhydrique d'une concentration quelconque.
Et les oxydes hydrure
La réaction avec du technétium hydrogène produit le chargé négativement hydrure TcH 2-
9 ion, qui a le même type de structure cristalline que (a isostructural avec) ReH 2-
9. Il se compose d'un prisme trigone avec un atome de technetium dans le centre et six des atomes d'hydrogène dans les coins. Trois plusieurs atomes d'hydrogène font un triangle se étendant parallèlement à la base et traversant le prisme en son centre. Bien que les atomes d'hydrogène ne sont pas géométriquement équivalents, leur structure électronique est à peu près la même. Ce complexe dispose d'une nombre de coordination de neuf (ce qui signifie que l'atome de technetium a neuf voisins), qui est la plus élevée pour un complexe de technétium. Deux atomes d'hydrogène dans le complexe peuvent être remplacés par des ions (K +) sodium (Na +) ou potassium.

Technétium métallique lentement ternit dans l'air humide, et sous forme de poudre, va brûler dans l'oxygène . Deux oxydes ont été observés: TCO 2 et Tc 2 O 7. Sous conditions oxydantes, qui ont tendance à dépouiller les électrons des atomes, le technétium (VII) seront exister en tant que pertechnétate ion , TCO -
4.
À des températures de 400 à 450 ° C, le technétium se oxyde pour former le jaune pâle heptoxyde:
- 4 Tc + 7 O 2 → 2 Tc 2 O 7
Ce composé adopte une la structure centrosymétrique avec deux types d'obligations Tc-O; leurs longueurs de liaison sont 167 et 184 heures, et l'angle O-Tc-O est de 180 °.
Heptoxyde technétium est le précurseur de pertechnétate de sodium:
- Tc 2 O 7 + 2 NaOH → NATCO 2 4 + H 2 O
Noir de couleur dioxyde de technétium (TCO 2) peut être produit par réduction de l'heptoxyde avec du technétium ou de l'hydrogène.
Pertechnetic acide (HTCO 4) est produit par réaction Tc 2 O 7 avec de l'eau ou des acides oxydants, tels que l'acide nitrique , l'acide sulfurique concentré, l'eau régale, ou un mélange d'acides nitrique et chlorhydrique. Le rouge foncé résultante, hygroscopique (absorbant l'eau) substance est un acide fort et donne protons facilement. Dans concentré acide sulfurique Tc (VII) est converti en anion tetraoxidotechnetate la forme octaédrique de technetic (VII) TcO acide 3 (OH) (H 2 O) 2.
Le pertechnate (tetroxidotechnetate) anion TcO -
4 est constitué d'un tétraèdre avec des atomes d'oxygène dans les coins et un atome de technétium dans le centre. Contrairement à permanganate (MnO -
4), ce est seulement un agent oxydant faible. Pertechnétate est souvent utilisé comme une source d'isotopes de technétium, tels que 99mTc soluble dans l'eau convenable, et en tant que catalyseur .
Sulfures, séléniures, tellurures et
formes de technétium diverses sulfures. TcS 2 est obtenu par réaction directe du technétium et élémentaire du soufre , tandis que Tc 2 S 7 est formé à partir de l'acide pertechnic comme suit:
- 2 HTCO 4 + 7 H 2 S → Tc 2 S 7 + 8 H 2 O
Dans cette réaction est technétium réduit à Tc (IV) alors que les formes de soufre en excès de ligand un disulfure. Le heptasulfure de technétium produit a une structure polymère (Tc 3 (μ 3 -S) (S 2) 3 S 6) n avec un noyau semblable à Mo 3 (μ 3 -S) (S 2) 6 2-.
Lors du chauffage, le technétium heptasulfure décompose en disulfure et de soufre élémentaire:
- TC 2 S 7 → 2 TC 2 + 3 S
Des réactions analogues se produisent avec le sélénium et le tellure .

Technétium carbure et la phase métallique de technétium orthorhombique
Lorsque de petites quantités de carbone sont présents dans technétium métallique, sa structure idéale de cristal hexagonal compact est déformée à orthorhombique structure métallique de technétium. Teneur élevée en carbone (à partir de 15 à 17% à.) Fournir une conversion complète de technétium métal cube carbure de technétium avec la composition approximative de Tc6C. L'augmentation supplémentaire de la teneur en carbone ne fournit pas de changement dans la structure en carbure de technétium.
Clusters et complexes organiques
Plusieurs groupes de technétium sont connus, y compris quatre Tc, Tc 6, 8 et Tc Tc 13. Les plus stables Tc 6 et Tc huit grappes ont des formes prisme où les paires verticales de Tc atomes sont reliés par des liaisons triples et les atomes planes par des liaisons simples. Chaque atome de technétium fait six liaisons, et les électrons de valence restants peut être saturé par une axial et deux pontant les atomes d'halogène tels que les ligands de chlore ou de brome .

formes de technétium nombreux des complexes organiques, qui sont relativement bien étudiés en raison de leur importance pour la médecine nucléaire. Le technétium carbonyle (Tc 2 (CO) 10) est un solide blanc. Dans cette molécule, deux atomes de technetium sont faiblement liés entre eux; chaque atome est entouré d' octaèdres de cinq ligands carbonyle. La longueur de la liaison entre les atomes de technétium, 303 pm, est nettement plus grande que la distance entre deux atomes dans le technétium métallique (272 pm). Similaire carbonyles sont formés par de technétium congénères, le manganèse et le rhénium.
Complexe de technétium d'un ligand organique (représenté sur la figure de droite) est couramment utilisé en médecine nucléaire. Il a une Tc-O uniques groupement fonctionnel (fragment) orientée perpendiculairement au plan de la molécule, où l'atome d'oxygène peut être remplacé par un atome d'azote.
Isotopes
Le technétium, avec le numéro atomique (Z notée) 43, est l'élément le plus petit numéro dans le tableau périodique qui est exclusivement radioactifs. Le deuxième plus léger, exclusivement élément radioactif, le prométhium , a un numéro atomique de 61 ans. Les noyaux atomiques avec un nombre impair de protons sont moins stables que ceux avec les nombres pairs, même si le nombre total de nucléons (protons + neutrons ) sont encore. Éléments impaires ont donc moins stables isotopes .
Le plus stable isotopes radioactifs sont technétium-98 avec une demi-vie de 4,2 millions d'années ( Ma), du technétium-97 (demi-vie: 2,6 Ma) et le technétium-99 (demi-vie: 211000 années). Trente autres radio-isotopes ont été caractérisés avec nombres de masse allant de 85 à 118. La plupart de ceux-ci ont des demi-vies qui sont à moins d'une heure; les exceptions sont technétium-93 (demi-vie: 2,73 heures), le technétium-94 (demi-vie: 4,88 heures), le technétium-95 (demi-vie: 20 heures), et le technétium-96 (demi-vie: 4,3 jours ).
Le primaire mode de désintégration des isotopes plus légers que le technétium-98 (Tc 98) est capture d'électrons, donnant molybdène (Z = 42). Pour des isotopes plus lourds, le principal mode est émission bêta (l'émission d'un électron ou positrons), ce qui donne le ruthénium (Z = 44), à l'exception que le technétium-100 peut se décomposer à la fois par émission bêta et capture d'électrons.
Le technétium a également de nombreux isomères nucléaires, qui sont des isotopes ayant un ou plusieurs nucléons excités. Le technétium-97m (Tc 97m; «m» signifie métastabilité) est le plus stable, avec une demi-vie de 91 jours (0,0965 MeV). Il est suivi par le technétium-95m (demi-vie: 61 jours, 0,03 MeV), et le technétium-99m (demi-vie: 6,01 heures, 0,142 MeV). Le technétium-99m émet seulement rayons gamma et se désintègre en technétium-99.
Le technétium-99 (Tc 99) est un produit majeur de la fission de l'uranium-235 (235 U), ce qui en fait l'isotope le plus commun et le plus facilement disponible de technétium. Un gramme de technétium-99 produit 6,2 × 10 8 désintégrations par seconde (ce est-0,62 G Bq / g).
Présence et la production

Seules des traces minutes sont naturellement présents dans de la Terre la croûte comme spontanée produits de fission dans minerais d'uranium. Un kilogramme d'uranium contient environ 1 nanogramme (10 -9 g) de technétium. Certains géantes rouges étoiles avec les types spectraux S, M, N et contiennent une raie d'absorption dans leur spectre qui indique la présence de technétium. Ces rouges géants sont connus officieusement comme étoiles de technétium.
produit des déchets de fission
En contraste avec sa présence naturelle rare, grandes quantités de technétium-99 sont produits chaque année à partir de crayons combustibles nucléaires usés, qui contiennent divers produits de fission. La fission d'un gramme de l'uranium-235 en réacteurs nucléaires rendements 27 mg de technétium-99, donnant un technétium fission rendement du produit de 6,1%. Autre isotopes fissiles produisent également des rendements similaires de technétium, tels que 4,9% de l'uranium 233 et 6,21% du plutonium-239. A propos de 49 000 T Bq (78 tonnes métriques) de technétium est estimé avoir été produite dans les réacteurs nucléaires entre 1983 et 1994, qui est de loin la principale source de technétium terrestre. Seule une fraction de la production est utilisé dans le commerce.
Le technétium-99 est produite par la fission nucléaire de l'uranium 235 fois et le plutonium-239. Il est donc présent dans déchets radioactifs et dans le les retombées nucléaires de fission bombe explosions. Sa désintégration, mesurée en becquerels par quantité de combustible usé, est dominante après environ 10 avril au 10 juin ans après la création des déchets nucléaires. De 1945 à 1994, on estime que 160 T Bq (environ 250 kg) de technétium-99 a été libéré dans l'environnement par l'atmosphère essais nucléaires. La quantité de technétium-99 à partir de réacteurs nucléaires rejetés dans l'environnement jusqu'à 1986 est de l'ordre de 1 000 TBq (environ 1600 kg), principalement par retraitement de combustible nucléaire; la plupart de ces a été déversé dans la mer. Méthodes de préparation ont réduit leurs émissions depuis, mais à partir de 2005 la libération primaire de technétium-99 dans l'environnement est par la Sellafield usine, qui a publié un estimé 550 TBq (environ 900 kg) de 1995 à 1999 dans la mer d'Irlande . A partir de 2000 le montant a été limitée par la réglementation à 90 TBq (environ 140 kg) par an. Décharge du technétium dans la mer a donné lieu à des fruits de mer contenant des quantités minuscules de cet élément. Par exemple, Homard européen et poissons de l'ouest Cumbria contient environ 1 Bq / kg de technétium.
produits de fission pour un usage commercial
Le isotope métastable technétium-99m est produit en continu en tant que produits de fission de la fission de l'uranium ou du plutonium dans les réacteurs nucléaires. Parce que le carburant utilisé est laissé au repos pendant plusieurs années avant retraitement, tout le molybdène-99 et le technétium-99m auront pourri par le temps que les produits de fission sont séparés des principaux actinides en classique retraitement nucléaire. Le liquide qui reste après l'extraction de l'uranium du plutonium ( PUREX) contient une concentration élevée de technétium TCO -
4 mais presque tout cela est le technétium-99, pas de technétium-99m.
La grande majorité du technétium-99m utilisé dans le travail médical est produit par irradiation dédié hautement enrichi cibles d'uranium dans un réacteur, l'extraction du molybdène-99 des cibles dans les installations de retraitement, et la récupération au centre de diagnostic du technétium-99m qui est produit lors de la décomposition du molybdène-99. Molybdène-99 sous forme de molybdate MoO 2-
La figure 4 est adsorbé sur de l'alumine acide (Al 2 O 3) dans un blindé Chromatographie sur colonne à l'intérieur d'un générateur de technétium-99m ("vache technétium", aussi parfois appelé une «vache de molybdène"). Molybdène-99 a une demi-vie de 67 heures, afin de technétium-99m de courte durée (demi-vie: 6 heures), qui résulte de sa décadence, est produit en permanence. La soluble pertechnétate TcO -
4 peut alors être extraite chimiquement par élution à l'aide d'un une solution saline.
Par irradiation d'une cible d'uranium hautement enrichi pour produire du molybdène-99, il ne est pas nécessaire pour les étapes chimiques complexes qui seraient nécessaires pour séparer le molybdène à partir d'un mélange de produits de fission. Un inconvénient de ce procédé est qu'il nécessite des cibles contenant de l'uranium-235, qui sont soumis à des précautions de sécurité de matières fissiles.
Près des deux tiers de la production mondiale provient de deux réacteurs; la Réacteur national de recherche universel au Laboratoires de Chalk River en Ontario, au Canada, et de la Haute Reactor Flux au La recherche nucléaire et Consultancy Group à Petten, Pays-Bas. Tous les grands réacteurs technétium-99m producteurs ont été construits dans les années 1960 et sont proches de la fin de leur durée de vie. Les deux nouveaux canadienne Multipurpose Applied Physics Lattice Experiment réacteurs planifiés et construits pour produire 200% de la demande de technétium-99m soulagés tous les autres producteurs de construire leurs propres réacteurs. Avec l'annulation des réacteurs déjà testés en 2008 l'offre future de technétium-99m est devenu très problématique.
Toutefois, le réacteur de Chalk River a été fermé pour l'entretien depuis Août 2009, avec une réouverture prévue en Avril 2010, et le réacteur Petten eu un arrêt programmé de six mois de constitution débutant le vendredi 19 Février, 2010. Avec des millions de procédures en se appuyant sur technétium-99m chaque année, la faiblesse de l'offre a laissé un vide, laissant certains praticiens de revenir à des techniques ne sont pas utilisés pendant 20 ans. Un peu apaiser cette question est une annonce du polonais Maria réacteur de recherche qu'ils ont développé une technique pour isoler technétium. Le réacteur de Chalk River Laboratoire rouvert en Août 2010 et le réacteur de Petten rouvert Septembre de 2010.
L'élimination des déchets
La longue demi-vie du technétium-99 et sa capacité à former un anioniques espèces rend une préoccupation majeure pour l'élimination à long terme des déchets radioactifs. Bon nombre des processus visant à éliminer les produits de fission dans les usines de retraitement visent à cationiques espèces comme le césium (par exemple, le césium-137) et de strontium (par exemple, strontium-90). D'où le pertechnétate est capable de se échapper par ces procédés de traitement. Options d'élimination actuels favorisent sépulture dans la roche continentale, géologiquement stable. Le principal danger avec un tel cours est que les déchets est susceptible d'entrer en contact avec l'eau, ce qui pourrait se infiltrer contamination radioactive dans l'environnement. Le pertechnétate anionique et iodure ne adsorbent pas bien sur les surfaces de minéraux, de sorte qu'ils sont susceptibles d'être emportés. En comparaison du plutonium , de l'uranium , et le césium sont beaucoup plus capable de se lier aux particules du sol. Technétium pourrait également être immobilisé par certains environnements, comme le lac sédiments de fond, en raison de l'activité microbienne; pour cette raison, la chimie de l'environnement de technétium est un domaine actif de recherche.
Une méthode d'élimination de rechange, transmutation, il a été démontré au CERN pour le technétium-99. Ce processus de transmutation est celle dans laquelle le technétium (technétium-99 en tant que cible de métal) est bombardée par des neutrons pour former le technétium-100 de courte durée (demi-vie = 16 secondes) qui se désintègre par désintégration bêta de ruthénium -100. Si la récupération de ruthénium utilisable est un objectif, un objectif de technétium extrêmement pur est nécessaire; si de petites traces de la actinides mineurs tels que l'américium et curium sont présents dans la cible, elles sont susceptibles de subir une fission et former plus produits de fission qui augmentent la radioactivité de la cible irradiée. La formation de ruthénium-106 (demi-vie de 374 jours) à partir du "fission frais» est susceptible d'augmenter l'activité du métal de ruthénium finale, qui sera alors nécessiter un temps plus long refroidissement après irradiation avant le ruthénium peut être utilisé.
La séparation effective de technétium-99 à partir de combustible nucléaire usé est un long processus. Pendant retraitement du combustible, il apparaît dans le liquide résiduel, ce qui est hautement radioactifs. Après s'être assis pendant plusieurs années, la radioactivité tombe à un point où l'extraction des isotopes à long terme, y compris le technétium-99, devient possible. Plusieurs procédés d'extraction chimique sont ensuite utilisés, ce qui donne le technétium-99 en métal de haute pureté.
activation neutronique
Le molybdène-99 peut être formée par le neutron activation du molybdène-98. D'autres isotopes de technétium ne sont pas produites en quantités importantes par la fission; si nécessaire, ils sont fabriqués par irradiation neutronique des isotopes mères (par exemple, le technétium-97 peut être effectué par irradiation neutronique de ruthénium-96).
Les accélérateurs de particules
La faisabilité de la production de technétium-99m avec le bombardement de 22 MeV-proton d'une cible de molybdène-100 cyclotrons médicaux suite à la réaction 99m 100 Mo (p, 2n) Tc a été démontré en 1971. Les récentes pénuries de technétium-99m médicaux relancé l'intérêt dans sa production par bombardement de protons isotope enrichi (> 99,5%) de molybdène-100 cibles. Les techniques de production d'isotopes par accélérateur autres particules ont été étudiés afin d'obtenir du molybdène-99 à partir de molybdène-100 via (n, 2n) ou (γ, n) réactions.
Applications
La médecine nucléaire et de la biologie

Le technétium-99m ("m" indique que ce est un isomère nucléaire métastable) est utilisé dans isotope radioactif tests médicaux, par exemple en tant que traceur radioactif que l'équipement médical peut déceler dans le corps humain. Il est bien adapté pour le rôle parce qu'il émet facilement détectable 140 keV des rayons gamma, et sa demi-vie est 6,01 heures (ce qui signifie qu'environ 94% de celui-ci se désintègre en technétium-99 à 24 heures). Il ya au moins 31 couramment utilisés produits radiopharmaceutiques à base de technétium-99m pour l'imagerie et des études fonctionnelles de la cerveau, myocarde, thyroïde, les poumons, foie, la vésicule biliaire, les reins , squelette, sang , et tumeurs.
L'isotope technétium-95m long vécu, avec une demi-vie de 61 jours, est utilisé comme traceur radioactif pour étudier le déplacement de technétium dans l'environnement et dans des systèmes de plantes et d'animaux.
Industrielle et chimique
Le technétium-99 se désintègre presque entièrement par la désintégration bêta, émettant des particules bêta avec des énergies faibles cohérentes et aucun des rayons gamma d'accompagnement. De plus, sa demi-vie longue signifie que cette émission diminue très lentement dans le temps. Il peut également être extrait à une pureté chimique et isotopique élevée des déchets radioactifs. Pour ces raisons, il est un National Institute of Standards and Technology (NIST) d'émetteur bêta standard, et est donc utilisés pour l'étalonnage de l'équipement. Le technétium-99 a également été proposé pour une utilisation dans des dispositifs optoélectroniques et échelle nanométrique batteries nucléaires.
Comme rhénium et palladium , le technétium peut servir de catalyseur . Pour certaines réactions, par exemple la déshydrogénation de l'alcool isopropylique, ce est un catalyseur bien plus efficace que le rhénium ou le palladium. Cependant, sa radioactivité est un problème majeur dans la recherche des applications catalytiques sûres.
Lorsque l'acier est immergé dans l'eau, l'ajout d'une faible concentration (55 ppm) de pertechnétate de potassium (VII) à l'eau protège la acier contre la corrosion, même si on élève la température à 250 ° C. Pour cette raison, pertechnétate a été utilisé comme un anodique possible corrosion inhibiteur de l'acier, bien que la radioactivité du technétium pose des problèmes qui limitent cette application pour les systèmes autonomes. Bien que (par exemple) CrO 2-
4 peut également inhiber la corrosion, il faut une concentration dix fois plus élevé. Dans une expérience, un échantillon d'acier au carbone a été maintenu dans une solution aqueuse de pertechnétate depuis 20 ans et était encore non corrodés. Le mécanisme par lequel pertechnétate empêche la corrosion ne est pas bien comprise, mais semble impliquer la formation réversible d'une mince couche de surface. Une théorie est que le pertechnétate réagit avec la surface de l'acier pour former une couche de technétium dioxyde qui empêche en outre la corrosion; le même effet explique comment la poudre de fer peut être utilisé pour éliminer l'eau de pertechnétate. ( Le charbon actif peut également être utilisé pour le même effet). L'effet disparaît rapidement si la concentration de pertechnétate est inférieure à la concentration minimum ou si une concentration trop élevée d'autres ions est ajouté.
Comme indiqué, la nature radioactive du technétium (3 M Bq par litre aux concentrations nécessaires) rend cette protection contre la corrosion pas pratique dans presque toutes les situations. Néanmoins, protection contre la corrosion par les ions pertechnétate a été proposé (mais jamais adopté) pour utilisation dans réacteurs à eau bouillante.
Précautions
Technétium ne joue aucun rôle biologique naturel et ne est pas normalement trouvé dans le corps humain. Le technétium est produit en quantité par fission nucléaire, et se propage plus facilement que de nombreux radionucléides. Elle semble avoir une faible toxicité chimique. Par exemple, aucun changement significatif dans la formule sanguine, du poids corporel et d'organes, et la consommation alimentaire a pu être détectée chez les rats qui ont ingéré jusqu'à 15 pg de technétium-99 par gramme de nourriture pendant plusieurs semaines. La toxicité radiologique du technétium (par unité de masse) est une fonction du composé, le type de rayonnement de l'isotope en question, et la demi-vie de l'isotope.
Tous les isotopes de technétium doivent être manipulés avec précaution. L'isotope le plus commun, le technétium-99, est un bêta faible émetteur; un tel rayonnement est arrêtée par les parois de la verrerie de laboratoire. Le danger principal lorsque vous travaillez avec le technétium est l'inhalation de poussière; tel contamination radioactive dans les poumons peut poser un risque important de cancer. Pour la plupart des travaux, une manipulation prudente dans un hotte est suffisante; une boîte à gants ne est pas nécessaire.
