
Gadolinium
Renseignements généraux
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Gadolinium | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
64 Gd | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
blanc argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | gadolinium, D.ieu, 64 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ˌ ɡ æ ré ə l ɪ n Je ə m / GAD -ə--əm de LIN | ||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | lanthanides | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 157,25 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 7 5d 1 6s 2 2, 8, 18, 25, 9, 2 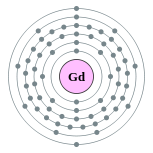 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Jean Charles Galissard de Marignac (1880) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Lecoq de Boisbaudran (1886) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 7,90 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 7,4 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1585 K , 1312 ° C, 2394 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3546 K, 3273 ° C, 5923 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 10,05 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 301,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 37,03 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur (calculé) | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 1, 2, 3 (modérément oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,20 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 593,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1170 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 1990 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 180 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 196 ± 18 heures | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | ferromagnétique / paramagnétique transition à 293,4 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (α, poly) 1,310 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 10,6 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (100 ° C, α, le poly) 9,4 um / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,680 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | (Formulaire de α) 54,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | (Formulaire de α) 21,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | (Formulaire de α) 37,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | (Formulaire de α) 0,259 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 570 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-54-2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de gadolinium | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Le gadolinium est un élément chimique avec le symbole Gd et de numéro atomique 64. Ce est un blanc argenté, malléable et ductile métal des terres rares. Il se trouve dans la nature que dans combinée (sel) forme. Gadolinium a été détecté pour la première en 1880 par spectroscopie de Marignac qui se est séparé de son oxyde et est crédité de sa découverte. Il est nommé pour gadolinite, un des minéraux dans lequel il a été constaté, à son tour nommé pour chimiste Johan Gadolin. Le métal a été isolé par Paul Émile Lecoq de Boisbaudran en 1886.
Gadolinium métallique possède inhabituelles métallurgiques propriétés, dans la mesure où aussi peu que 1% de gadolinium peut améliorer considérablement la maniabilité et la résistance à haute température oxydation du fer , du chrome , et associée alliages. Gadolinium comme un sel métallique ou a exceptionnellement élevé absorption de neutrons et donc est utilisé pour protéger des neutrons et en radiographie les réacteurs nucléaires. Comme la plupart des terres rares, le gadolinium forme trivalents ions qui ont des propriétés fluorescentes. Gd sels (III) ont donc été utilisés comme luminophores verts dans diverses applications.
L'ion Gd (III) au cours de sels solubles dans l'eau est très toxique pour les mammifères. Cependant, Gd composés chélatés (III) sont beaucoup moins toxiques parce qu'ils portent Gd (III) par les reins et sur le corps avant l'ion libre peut être libéré dans les tissus. En raison de sa propriétés paramagnétiques, solutions de chélate organique gadolinium des complexes sont utilisés comme administré par voie intraveineuse agents de contraste IRM à base de gadolinium dans médical imagerie par résonance magnétique. Cependant, dans une petite minorité de patients souffrant d'insuffisance rénale, au moins quatre de ces agents ont été associés avec le développement de la maladie inflammatoire nodulaire rares fibrose systémique néphrogénique. Ceci est considéré être dû à l'ion gadolinium elle-même, puisque les molécules de Gd (III) de support associés à la maladie diffèrent.
Caractéristiques

Propriétés physiques
Le gadolinium est un blanc argenté malléable et ductile métal des terres rares. Il cristallise dans hexagonale, serrée forme α- à la température ambiante, mais, lorsqu'il est chauffé à des températures supérieures à 1235 ° C, il se transforme en sa forme β-, qui a une corps-centré structure cubique.
Gadolinium-157 a le plus haut neutrons thermiques capturer section entre des nucléides stables: 259000 granges. Seulement xénon-135 a une section transversale supérieure, 2000000 étables, mais qui est isotope instable.
Le gadolinium est ferromagnétique à des températures inférieures à 20 ° C (68 ° F) et est fortement paramagnétique au-dessus de cette température. Gadolinium démontre une effet magnétocalorique de sorte que sa température augmente quand il entre dans un champ magnétique et diminue quand il quitte le champ magnétique. La température abaissée à (5 ° C (41 ° F)) pour le gadolinium alliage Gd Er 85 15, et l'effet est nettement plus forte pour l'alliage Gd 5 ( Si 2 Ge 2), mais à une température beaucoup plus faible (<85 K (-188,2 ° C; -306,7 ° F)).
Atomes de gadolinium individuels ont été isolés en les encapsulant dans molécules de fullerène et visualisées avec Microscope électronique à transmission. Atomes individuels et petits groupes Gd Gd ont également été incorporées dans des nanotubes de carbone.
Propriétés chimiques
Le gadolinium se combine avec la plupart des éléments pour former des dérivés de Gd (III). l'azote, le carbone, le soufre, le phosphore, le bore, le sélénium, le silicium et l'arsenic à des températures élevées, en formant des composés binaires.
Contrairement à d'autres éléments des terres rares, le gadolinium métallique est relativement stable à l'air sec. Toutefois, il ternit rapidement dans l'air humide, formant un lâche adhérant gadolinium (III) oxyde (Gd 2 O 3), qui éclats, exposant plus de surface à l'oxydation.
- 4 Gd + 3 O 2 → 2 Gd 2 O 3
Gadolinium est une forte l'agent, ce qui réduit les oxydes de plusieurs métaux dans leurs éléments réducteur. Gadolinium est assez électropositive et réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former l'hydroxyde de gadolinium:
- 2 Gd + 6 H 2 O → 2 Gd (OH) 3 + 3 H 2
Gadolinium métal est attaqué facilement dilué par de l'acide sulfurique pour former des solutions contenant de l'incolore Gd (III), des ions qui existent en tant que [Gd (OH 2)] 9 3+ complexes:
- 2 Gd + 3 H 2 SO 4 + 18 H 2 O 2 → [Gd (H 2 O) 9] 3+ + 3 SO 4 2- + 3 H 2
Gadolinium métal réagit avec les halogènes (X 2) à la température d'environ 200 ° C:
- 2 Gd + 3 X 2 → 2 GdX 3
Les composés chimiques
Dans la grande majorité de ses composés, D.ieu adopte l' état d'oxydation +3. Les quatre trihalogénures sont connus. Tous sont blanc, sauf pour l'iodure, qui est jaune. Le plus souvent rencontré des halogénures est gadolinium (III) chlorure (GdCl 3). L'oxyde se dissout dans les acides pour donner les sels, tels que gadolinium (III) nitrate.
Gadolinium (III), comme la plupart des ions lanthanides, formes complexes à forte nombres de coordination. Cette tendance est illustrée par l'utilisation de l'agent chélatant DOTA, un octa ligand denté. Sels de [Gd (DOTA)] - sont utiles dans imagerie par résonance magnétique. Une variété de complexes chelates connexes ont été développées, y compris gadodiamide.
Composés de gadolinium réduits sont connus, en particulier à l'état solide. Gadolinium halogénures (II) sont obtenus par chauffage Gd (III) en présence des halogénures métalliques D.ieu dans des conteneurs de tantale. Le gadolinium font également sesquichlorure Gd 2 Cl 3, qui peut être encore réduit à GdCl par recuit à 800 ° C. Ce gadolinium (I) chlorure formes plaquettes avec une structure de type graphite en couches.
Isotopes
Naturellement gadolinium survenant est composé de six stables isotopes , 154 Gd, Gd 155, 156 Gd, Gd 157, 158 et 160 Gd Gd, et une radio-isotope, 152 Gd, avec 158 Gd étant le plus abondant (24,84% abondance naturelle). Le double désintégration bêta prévue de 160 D.ieu n'a jamais été observé (la limite inférieure que sur sa demi-vie de plus de 1,3 × 10 21 années a été mis expérimentalement).
Vingt-neuf des radio-isotopes ont été caractérisés, avec le plus stable étant 152 Gd (naturellement) avec une demi-vie de 1,08 × 10 14 années, et 150 Gd avec une demi-vie de 1,79 × 10 6 années décomposition alpha. Tous les isotopes radioactifs restants ont des demi-vies de moins de 74,7 années. La majorité d'entre eux ont des demi-vies de moins de 24,6 secondes. isotopes de gadolinium ont 4 métastable isomères, avec l'être le plus stable 143m Gd (T ½ = 110 secondes), 145m Gd (T ½ = 85 secondes) et 141m Gd (T ½ = 24,5 secondes).
Isotopes avec masses atomiques inférieurs à la isotope stable le plus abondant, 158 Gd, principalement par l'intermédiaire de décroissance capture d'électrons à Eu ( europium ) isotopes. Au masses atomiques plus élevés, le primaire mode de désintégration est désintégration bêta, et les produits primaires sont Tb ( terbium ) isotopes.
Histoire
Gadolinium est nommé du minéral gadolinite, à son tour nommé pour finlandaise chimiste et géologue Johan Gadolin. En 1880, Swiss chimiste Jean Charles Galissard de Marignac observé lignes spectroscopiques en raison de gadolinium dans des échantillons de gadolinite (qui contient en fait relativement peu de gadolinium, mais assez pour montrer un spectre), et le minéral séparée cerite. Le dernier minéral se est avéré contenir beaucoup plus de l'élément avec la nouvelle ligne spectrale, et Jean Charles Galissard de Marignac fini par se séparer un oxyde minéral de cerite qu'il a réalisé est l'oxyde de ce nouvel élément. Il a nommé l'oxyde " gadolinium. "Parce qu'il a réalisé que" gadolinium "était l'oxyde d'un nouvel élément, il est crédité de découverte de gadolinium. Français chimiste Paul Émile Lecoq de Boisbaudran effectivement réalisée la séparation du gadolinium métal du gadolinium, en 1886.
Occurrence
Le gadolinium est un constituant dans de nombreux minéraux tels que monazite et bastnäsite, qui sont des oxydes. Le métal est trop réactif pour exister naturellement. Ironiquement, comme indiqué ci-dessus, le minéral gadolinite contient en fait que des traces de D.ieu. L'abondance dans la croûte terrestre est d'environ 6,2 mg / kg. Les principales zones minières sont la Chine, Etats-Unis, le Brésil, le Sri Lanka, l'Inde et l'Australie avec des réserves devrait dépasser un million de tonnes. La production mondiale de gadolinium pur est d'environ 400 tonnes par an.
Production
Gadolinium est produit à la fois de la monazite et bastnäsite.
- Minéraux broyés sont extraits avec chlorhydrique ou l'acide sulfurique , qui convertit les oxydes insolubles en chlorures ou des sulfates solubles.
- Les filtrats acides sont partiellement neutralisés avec de la soude caustique à pH 3-4. thorium précipite comme l'hydroxyde et est retirée.
- La solution restante est traitée avec oxalate d'ammonium pour convertir les terres rares pour leur insoluble oxalates. Les oxalates sont convertis en oxydes par chauffage.
- Les oxydes sont dissous dans de l'acide nitrique qui exclut l'un des principaux composants, le cérium , dont l'oxyde est insoluble dans HNO 3.
- La solution est traitée avec le nitrate de magnésium pour produire un mélange cristallisé de doubles sels de gadolinium, le samarium et l'europium .
- Les sels sont séparés par Chromatographie d'échange d'ions.
- Les ions de terre rare sont ensuite lavées de façon sélective par un agent complexant approprié.
Gadolinium métal est obtenu à partir de son oxyde ou de sels par chauffage avec du calcium à 1450 ° C sous atmosphère d'argon. Sponge gadolinium peut être produit en réduisant fondu GdCl 3 avec un métal approprié à des températures inférieures 1312 ° C (point de fusion de D.ieu) dans une pression réduite.
Applications
Gadolinium n'a pas les applications à grande échelle, mais a une variété d'utilisations spécialisées.
Gadolinium a neutron section la plus élevée parmi tous les nucléides stables:. 61 000 155 granges pour D.ieu et granges 259 000 pour 157 157 Gd Gd a été utilisée pour cibler les tumeurs dans la thérapie de neutrons. Cet élément est très efficace pour une utilisation avec neutronographie et blindage les réacteurs nucléaires. Il est utilisé comme une mesure d'arrêt secondaire, d'urgence dans certains réacteurs nucléaires, en particulier de la Type CANDU. Le gadolinium est également utilisé dans systèmes de propulsion marins nucléaires comme un poison consommable.
Gadolinium possède également inhabituelles métallurgiques propriétés, avec aussi peu que 1% de gadolinium amélioration de l'aptitude au façonnage et la résistance de fer , de chrome , et est associée les alliages à des températures élevées et l'oxydation.
Gadolinium est paramagnétique à température ambiante, avec un point de Curie ferromagnétique de 20 ° C. Des ions paramagnétiques tels que le gadolinium, se déplacent différemment dans un champ magnétique. Ce trait fait gadolinium utile pour l'imagerie par résonance magnétique (IRM). Solutions de bio gadolinium et les composés complexes de gadolinium sont utilisés comme intraveineuse Agent de contraste IRM pour rehausser l'image médicale imagerie par résonance magnétique et angiographie par résonance magnétique (ARM) des procédures. Magnevist est l'exemple le plus répandu. Nanotubes emballés avec gadolinium, surnommé "gadonanotubes," sont 40 fois plus efficace que cet agent traditionnelle de contraste à base de gadolinium. Une fois injecté, des agents de contraste à base de gadolinium se accumulent dans les tissus anormaux du cerveau et du corps. Cette accumulation fournit un plus grand contraste entre les tissus normaux et anormaux, ce qui permet aux médecins de mieux localiser excroissances et tumeurs des cellules rares.
Le gadolinium en tant que substance luminescente est aussi utilisé dans d'autres images. En Systèmes à rayons X, le gadolinium est contenu dans la couche de phosphore, en suspension dans une matrice de polymère au niveau du détecteur. Terbium - dopée oxysulfure de gadolinium (Gd 2 O 2 S: Tb) à la couche de luminophore convertit les rayons X libérées de la source dans la lumière. Ce matériau émettant de la lumière verte à 540 nm due à la présence de Tb 3+, qui est très utile pour améliorer la qualité de l'imagerie. La conversion de l'énergie de Gd est jusqu'à 20%, ce qui signifie qu'un cinquième des rayons X frappant la couche de substance fluorescente peut être converti en photons lumineux. Oxyorthosilicate de gadolinium (Gd 2 SiO 5, BSG, le plus souvent dopé par 0,1 à 1% de Ce ) est un monocristal qui est utilisé en tant que scintillateur en imagerie médicale tels que tomographie par tomographie par émission ou pour la détection des neutrons.
composés de gadolinium sont aussi utilisés pour la fabrication de vert luminophores pour la couleur TV tubes, et dans la fabrication de disques compacts .
Gadolinium-153 est produit dans un réacteur nucléaire à partir de l'europium élémentaire ou des cibles de gadolinium enrichi. Elle a une demi-vie de 240 ± 10 jours et émet un rayonnement gamma avec de forts pics à 41 keV et 102 keV. Il est utilisé dans de nombreuses applications d'assurance qualité, telles que les sources de ligne et de fantômes d'étalonnage, afin de se assurer que les systèmes d'imagerie en médecine nucléaire fonctionnent correctement et produisent des images utiles de la distribution de radio-isotopes à l'intérieur du patient. Il est également utilisé comme source de rayons gamma dans des mesures d'absorption des rayons X ou à jauges de densité osseuse pour dépistage de l'ostéoporose, ainsi que dans le système d'imagerie à rayons X portable Lixiscope.
Le gadolinium sert à faire gadolinium grenat d'yttrium (Gd: Y 3 Al 5 O 12); ça a des applications micro-ondes et est utilisé dans la fabrication de divers composants optiques et en tant que matériau de substrat pour les films magnéto-optiques.
Gadolinium grenat de gallium (GGG, Gd 3 Ga 5 O 12) a été utilisé pour les diamants d'imitation et pour l'ordinateur la mémoire à bulles.
Rôle biologique
Gadolinium n'a aucun rôle biologique indigène connue, mais ses composés sont utilisés comme outils de recherche en biomédecine. Les composés de Gd sont des composants de Agents de contraste IRM. Il est utilisé dans diverses ion expériences d'électrophysiologie canal pour bloquer les canaux de fuite de sodium et étendent les canaux ioniques activés.
Sécurité
Comme un ion libre, le gadolinium est rapporté souvent hautement toxiques, mais les agents de contraste d'IRM sont chélaté composés et sont considérés comme suffisamment sûr pour être utilisé dans la plupart des personnes. Ions gadolinium libre toxicité chez les animaux est due à interférer avec un certain nombre de processus dépendant canal calcium ionique. La dose létale à 50% est d'environ 100 à 200 mg / kg. Aucune toxicité prolongées ont été rapportés après une exposition à faible dose à des ions de gadolinium. Les études de toxicité chez les rongeurs, mais montrent que la chélation de gadolinium (ce qui améliore également la solubilité) diminue sa toxicité à l'égard de l'ion libre par au moins un facteur de 100 (ce est à dire, la dose létale pour les Gd-chelate augmente de 100 fois) . On pense donc que la toxicité clinique des agents de contraste Gd chez l'homme dépend de la force de l'agent chélatant; Cependant cette recherche ne est pas encore complète. Environ une douzaine de différents agents Gd-chélaté ont été approuvés comme agents de contraste IRM à travers le monde.
Gadolinium agents de contraste IRM ont prouvé plus sûr que les agents de contraste iodés utilisés en radiographie aux rayons X ou tomodensitométrie. Des réactions anaphylactoïdes sont rares, survenant chez environ 0,03-0,1%.
Bien que les agents de gadolinium sont avérées utiles pour les patients atteints d'insuffisance rénale, chez les patients atteints d'insuffisance rénale sévère nécessitant une dialyse, il ya un risque de maladies rares mais graves, appelé la fibrose néphrogénique systémique (NSF) ou dermopathie néphrogénique fibrosante, qui a été liée à l'utilisation de quatre agents de contraste IRM contenant du gadolinium. Les maladies ressemble scléromyxœdème et dans une certaine mesure, la sclérodermie. Il peut se produire mois après contraste a été injecté. Son association avec gadolinium et non la molécule porteuse est confirmée par son apparition à partir de matières de contraste gadolinium dans lequel est porté par très différentes molécules porteuses.
Les lignes directrices actuelles dans le États-Unis sont que les patients de dialyse ne devraient recevoir des agents de gadolinium où essentiel et à envisager d'effectuer un contraste iodé CT améliorée lorsque cela est possible. Si un contraste amélioré IRM doit être effectuée sur un patient sous dialyse, il est recommandé que certains agents de contraste à haut risque être évitées et une dose plus faible que prises en considération. L'American College of Radiology recommande contraste amélioré examens IRM être effectués aussi près que possible avant la dialyse par mesure de précaution, même si cela n'a pas été prouvé de réduire la probabilité de développer la NSF.

