
Samarium
À propos de ce écoles sélection Wikipedia
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. Cliquez ici pour plus d'informations sur les enfants SOS.
| Samarium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
62 Sm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | samarium, Sm, 62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / s ə m ɛər Je ə m / sə- MAIR -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | lanthanides | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 150,36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 6s 2 6 2, 8, 18, 24, 8, 2 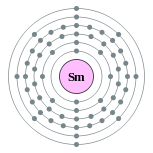 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Lecoq de Boisbaudran (1879) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Lecoq de Boisbaudran (1879) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 7,52 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 7,16 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1345 K , 1072 ° C, 1962 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2067 K, 1794 ° C, 3261 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 8,62 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 165 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 29,54 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2, 1 (Légèrement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,17 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 544,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1070 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2260 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 180 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 198 ± 20 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhomboédrique  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (α, poly) 0,940 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 13,3 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (α, poly) 12,7 um / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,130 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | (Formulaire de α) 49,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | (Formulaire de α) 19,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | (Formulaire de α) 37,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | (Formulaire de α) 0,274 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 412 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 441 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-19-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de samarium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le samarium est un élément chimique avec le symbole Sm et le numéro atomique 62. Ce est un argenté modérément dure métal qui se oxyde facilement dans l'air. Être un membre typique de la lanthanides série, le samarium assume généralement le degré d'oxydation +3. Les composés de samarium (II) sont également connus, notamment le monoxyde SMO monochalcogénures SMS, SMSE et SMTE, ainsi que samarium (II) d'iodure. Le dernier composé est un commune agent réducteur dans synthèse chimique. Samarium n'a aucun rôle biologique significatif et ne est que légèrement toxique.
Samarium a été découvert en 1879 par le chimiste français Paul Émile Lecoq de Boisbaudran et nommé d'après le minéral samarskite à partir duquel il a été isolé. Le minéral se était précédemment nommé d'après un fonctionnaire de la mine de Russie, le colonel Vasili Samarsky-Bykhovets qui devient ainsi la première personne à avoir un élément chimique qui porte son nom, quoique indirectement. Bien que classé comme un élément des terres rares, le samarium est l'élément le plus abondant dans la croûte 40e de la Terre et est plus fréquente que les métaux tels que l'étain . Samarium se produit avec une concentration jusqu'à 2,8% dans plusieurs minéraux dont cerite, gadolinite, samarskite, monazite et bastnäsite, les deux derniers étant des sources commerciales les plus courantes de l'élément. Ces minéraux se trouvent principalement dans la Chine , le Royaume-Unis , le Brésil , l'Inde , le Sri Lanka et l'Australie ; La Chine est de loin le leader mondial dans le secteur minier de samarium et de la production.
L'application commerciale majeure de samarium est en aimants samarium-cobalt, qui ont aimantation permanente secondes seulement aimants en néodyme; Cependant, les composés de samarium peuvent résister à des températures nettement plus élevées, au-dessus de 700 ° C, sans perdre leurs propriétés magnétiques. Le radioactive isotope samarium-153 est le composant majeur de la drogue samarium (153 Sm) lexidronam (Quadramet), qui tue les cellules cancéreuses dans le traitement de cancer du poumon , cancer de la prostate, cancer du sein et ostéosarcome. Un autre isotope, samarium-149, est une forte neutrons absorbeur et est donc ajouté à la des barres de commande les réacteurs nucléaires. Il est également formé en tant que produit de décomposition au cours du fonctionnement du réacteur et est l'un des facteurs importants pris en compte dans la conception et le fonctionnement du réacteur. D'autres applications de samarium incluent la catalyse de réactions chimiques , datation et une radioactifs Laser à rayons X.
Propriétés physiques
Le samarium est un métal des terres rares ayant la dureté et la densité similaires à ceux de zinc . Avec le point de 1794 ° C d'ébullition, le samarium est la troisième lanthanides plus volatile après l'ytterbium et l'europium ; cette propriété facilite la séparation de samarium du minerai. Dans des conditions ambiantes, le samarium assume normalement un la structure trigonale (forme de α). Lors du chauffage à 731 ° C, sa symétrie cristalline se transforme en hexagonale compacte (hcp), mais la température de transition dépend de la pureté du métal. Un chauffage supplémentaire à 922 ° C transforme le métal dans un (BCC) cubique phase centrée sur le corps. Chauffage à 300 ° C combinée à la compression à 40 Résultats de kbar dans une structure serrée double hexagonale (DHCP). En appliquant une pression élevée de l'ordre de centaines ou de milliers de kilobars induit une série de transformations de phase, en particulier avec un phase tétragonale apparaissant à environ 900 kbar. Dans une étude, la phase DHCP peut être produite sans compression en utilisant un régime de recuit de non-équilibre à un changement rapide de température comprise entre environ 400 et 700 ° C, ce qui confirme le caractère transitoire de cette phase de samarium. En outre, des films minces de samarium obtenus par dépôt en phase vapeur peuvent contenir le HCP ou DHCP phases dans les conditions ambiantes.
Samarium (et son sesquioxyde) sont paramagnétique à température ambiante. Les moments magnétiques effectifs correspondants, ci-dessous 2 μ B, sont la 3ème plus bas parmi les lanthanides (et leurs oxydes) après lanthane et lutécium. Le métal se transforme en un état antiferromagnétique lors du refroidissement à 14,8 K. individuelle atomes de samarium peut être isolé en les encapsulant dans molécules de fullerène. Ils peuvent également être dopées entre les molécules de C 60 dans la fullerène solide, rendant supraconducteurs à des températures inférieures à 8 K. dopage de samarium supraconducteurs à base de fer - la classe la plus récente de supraconducteurs à haute température - permet de renforcer leur température de transition à 56 K, qui est la valeur la plus élevée accomplis jusqu'ici dans cette série.
Propriétés chimiques
Samarium fraîchement préparé a un éclat argenté. Dans l'air, il se oxyde lentement à température ambiante et se enflamme spontanément à 150 ° C . Même lorsqu'il est conservé dans une huile minérale, oxyde de samarium et développe progressivement une poudre gris-jaune de la Oxyde hydroxyde mélange à la surface. L'aspect métallique d'un échantillon peut être conservé par scellement sous un gaz inerte tel que l' argon .
Samarium est assez électropositive et réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former l'hydroxyde de samarium:
- 2 Sm (s) + 6 H 2 O (l) 2 → Sm (OH) 3 (aq) + 3 H 2 (g)
Samarium se dissout facilement dans diluée d'acide sulfurique pour former des solutions contenant le jaune pâle Sm (III) des ions verts, qui existent en tant que [SM (OH 2)] 9 3+ complexes:
- 2 Sm (s) + 3 H 2 SO 4 (aq) → 2 Sm 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Samarium est l'un des rares lanthanides qui présentent l'état d'oxydation +2. Les ions Sm 2+ sont rouge sang dans les solutions.
Composés
| Formule | couleur | symétrie | groupe d'espace | Aucun | Symbole de Pearson | un (h) | b (h) | c (h) | Z | la densité, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Sm | argenté | trigone | R 3 m | 166 | HR9 | 362,9 | 362,9 | 2621,3 | 9 | 7,52 |
| Sm | argenté | hexagonal | P6 3 / mmc | 194 | HP4 | 362 | 362 | 1168 | 4 | 7,54 |
| Sm | argenté | quadrilatère | I4 / mmm | 139 | tI2 | 240,2 | 240,2 | 423,1 | 2 | 20,46 |
| SmO | d'or | cubique | Fm 3 m | 225 | cf8 | 494,3 | 494,3 | 494,3 | 4 | 9,15 |
| Sm 2 O 3 | trigone | P 3 m1 | 164 | HP5 | 377,8 | 377,8 | 594 | 1 | 7,89 | |
| Sm 2 O 3 | monoclinique | C2 / m | 12 | MS30 | 1418 | 362,4 | 885,5 | 6 | 7,76 | |
| Sm 2 O 3 | cubique | Ia 3 | 206 | cI80 | 1093 | 1093 | 1093 | 16 | 7.1 | |
| SmH 2 | cubique | Fm 3 m | 225 | CF12 | 537,73 | 537,73 | 537,73 | 4 | 6,51 | |
| SmH 3 | hexagonal | 3 P c1 | 165 | hP24 | 377,1 | 377,1 | 667,2 | 6 | ||
| Sm 2 B 5 | gris | monoclinique | P2 1 / c | 14 | MP28 | 717,9 | 718 | 720,5 | 4 | 6,49 |
| SmB 2 | hexagonal | P6 / mmm | 191 | HP3 | 331 | 331 | 401,9 | 1 | 7,49 | |
| SmB 4 | quadrilatère | P4 / mbm | 127 | TP20 | 717,9 | 717,9 | 406,7 | 4 | 6,14 | |
| SmB 6 | cubique | H 3 m | 221 | CP7 | 413,4 | 413,4 | 413,4 | 1 | 5,06 | |
| SmB 66 | cubique | Fm 3 c | 226 | cF1936 | 2348,7 | 2348,7 | 2348,7 | 24 | 2,66 | |
| Sm 2 C 3 | cubique | I 4 3d | 220 | cI40 | 839,89 | 839,89 | 839,89 | 8 | 7,55 | |
| SmC 2 | quadrilatère | I4 / mmm | 139 | Ti6 | 377 | 377 | 633,1 | 2 | 6,44 | |
| SmF 2 | pourpre | cubique | Fm 3 m | 225 | CF12 | 587,1 | 587,1 | 587,1 | 4 | 6,18 |
| SmF 3 | blanc | orthorhombique | Pnma | 62 | OP16 | 667,22 | 705,85 | 440,43 | 4 | 6,64 |
| SmCl 2 | brun | orthorhombique | Pnma | 62 | OP12 | 756,28 | 450,77 | 901,09 | 4 | 4,79 |
| SmCl 3 | jaune | hexagonal | P6 3 / m | 176 | HP8 | 737,33 | 737,33 | 416,84 | 2 | 4,35 |
| SMBR 2 | brun | orthorhombique | Pnma | 62 | OP12 | 797,7 | 475,4 | 950,6 | 4 | 5,72 |
| SMBR 3 | jaune | orthorhombique | Cmcm | 63 | oS16 | 404 | 1265 | 908 | 2 | 5,58 |
| SmI 2 | vert | monoclinique | P2 1 / c | 14 | MP12 | |||||
| SmI 3 | orange | trigone | R 3 | 63 | HR24 | 749 | 749 | 2080 | 6 | 5,24 |
| SMN | cubique | Fm 3 m | 225 | cf8 | 357 | 357 | 357 | 4 | 8,48 | |
| SMP | cubique | Fm 3 m | 225 | cf8 | 576 | 576 | 576 | 4 | 6.3 | |
| SMAS | cubique | Fm 3 m | 225 | cf8 | 591,5 | 591,5 | 591,5 | 4 | 7,23 |
Oxydes
L'oxyde plus stable de samarium est le sesquioxyde de Sm 2 O 3. Comme de nombreux autres composés de samarium, il existe en plusieurs phases cristallines. La forme trigonale est obtenue par refroidissement lent de la masse fondue. Le point de Sm 2 O 3 de fusion est plutôt élevé (2345 ° C) et donc la fusion est habituellement obtenue non pas par chauffage direct, mais avec chauffage par induction, à travers une bobine de radiofréquence. Le Sm 2 O 3 cristaux de symétrie monoclinique peuvent être cultivés par le procédé de fusion flamme ( Procédé Verneuil) de la Sm 2 O 3 en poudre, qui donne boules cylindriques jusqu'à plusieurs centimètres de long et d'environ un centimètre de diamètre. Les boules sont transparents à l'état pur et sans défaut et sont de couleur orange autrement. Le chauffage de la trigonal métastable Sm 2 O 3 à 1900 ° C convertit en la phase monoclinique plus stable. Cubique de Sm 2 O 3 a également été décrite.
Samarium est l'un des rares lanthanides qui forment un oxyde, SMO. Ce composé jaune d'or brillant a été obtenu par réduction de Sm 2 O 3, de samarium métallique à température élevée (1000 ° C) et pression supérieure à 50 kbars; l'abaissement de la pression conduit à une réaction incomplète. SmO a la structure de réseau cubique sel gemme.
Chalcogenides
Samarium forme trivalent sulfure, séléniure et tellurure. Bivalents chalcogénures SMS, SMSE et SMTE avec cube structure cristalline de sel gemme sont également connus. Ils sont remarquables par la conversion de semi-conducteur à l'état métallique à la température ambiante lors de l'application de la pression. Considérant que le passage est continu et se produit à environ 20 à 30 kbar dans SMSE et SMTE, il est brusque SMS et nécessite seulement 6,5 kbar. Cet effet résulte de changement de couleur spectaculaire dans SMS du noir au jaune d'or lorsque ses cristaux de films sont rayés ou poli. La transition ne change pas la symétrie de réseau, mais il existe une forte baisse (~ 15%) dans le volume du cristal. Il montre hystérésis, ce est lorsque la pression est relâchée, SMS revient à l'état semi-conducteur à beaucoup de pression inférieure d'environ 0,4 kbar.
Halogénures
Samarium métal réagit avec tous les halogènes X = F, Cl, Br ou I, formant des trihalogénures:
- 2 Sm (s) + 3 X 2 (g) → 2 SMX 3 (s)
Leur réduction supplémentaire avec samarium, de lithium ou de sodium métaux à des températures élevées (environ 700 à 900 ° C) donne dihalogénures. Le diiodure peut également être préparé en chauffant SmI 3, ou en faisant réagir le métal avec du 1,2-diiodoéthane dans anhydre tétrahydrofuranne à température ambiante:
- Sm (s) + ICH 2 CH 2 I → SmI 2 + CH 2 = CH 2.
En plus de dihalogénures, la réduction produit également de nombreux halogénures de samarium non stoechiométriques avec une structure cristalline bien définie, comme Sm 3 F 7, Sm 14 F 33, F 64 27 Sm, Sm 11 Br 24, Sm 5 Br 11 et Sm 6 Br 13.
Comme indiqué dans le tableau ci-dessus, les halogénures samarium changent leurs structures cristallines quand un type d'atomes halogénures est substitué à un autre, ce qui est un comportement rare pour la plupart des éléments (par exemple actinides). Beaucoup halogénures ont deux grandes phases de cristal pour une composition, une étant significativement plus stable et une autre étant métastable. Celui-ci est formé lors de la compression ou de chauffage, suivi d'une trempe à des conditions ambiantes. Par exemple, en comprimant le samarium monoclinique diiodure d'habitude et libérant les résultats de pression dans un PbCl 2 de type structure orthorhombique (densité 5,90 g / cm 3), et les résultats du traitement de façon semblable dans une nouvelle phase de samarium triiodure (densité 5,97 g / cm 3) .
Borures
Le frittage des poudres d'oxyde de samarium et de bore, dans le vide, on obtient une poudre contenant plusieurs phases de borure de samarium, et leur rapport en volume peut être contrôlée par la proportion de mélange. La poudre peut être convertie en cristaux plus grands d'un certain borure de samarium en utilisant arc de fusion ou techniques de fusion de la zone, en se appuyant sur les différentes température de SmB 6 (2580 ° C), SMB 4 (environ 2300 ° C) et SMB 66 (2150 ° C) de fusion / cristallisation. Tous ces matériaux sont durs, cassants, solides gris foncé avec la dureté augmentant avec la teneur en bore. Samarium diborure est trop volatile pour être produite avec ces méthodes et nécessite haute pression (environ 65 kbar) et les basses températures entre 1140 et 1240 ° C pour stabiliser sa croissance. L'augmentation de la température dans les formations préférentiels de SmB 6.
Samarium hexaborure
Samarium hexaborure est un composé intermédiaire valence typique où le samarium est présente à la fois comme Sm Sm 2+ et 3+ au rapport 3: 7. Il appartient à une classe de Kondo isolants, ce est à des températures élevées (supérieures à 50 K), ses propriétés sont typiques d'un métal Kondo, avec une conductivité électrique métallique, caractérisé par la dispersion des électrons forte, tandis qu'à des températures basses, il se comporte comme un isolant non-magnétique avec une étroite intervalle de bande d'environ 4 à 14 meV. La transition métal-isolant induite refroidissement dans SMB 6 est accompagnée d'une forte augmentation de la conductivité thermique, culminant à environ 15 K. La raison de cette augmentation est que les électrons eux-mêmes ne contribuent pas à la conductivité thermique à basse température, qui est dominé par phonons, mais la diminution de la concentration d'électrons réduit le taux de diffusion électron-phonon.
Nouvelle recherche semble montrer qu'il peut être un Isolant topologique.
D'autres composés inorganiques

Samarium carbures sont préparés par fusion d'un mélange graphite-métal dans une atmosphère inerte. Après la synthèse, ils sont instables à l'air et on étudie également sous atmosphère inerte. Samarium monophosphure SMP est un semi-conducteur avec la bande interdite de 1,10 eV, le même que dans le silicium , et une conductivité électrique élevée de type n . Il peut être préparé par un recuit à 1100 ° C d'une ampoule à quartz sous vide contenant des poudres mixtes de phosphore et de samarium. Le phosphore est très volatil à des températures élevées et peut exploser, donc la vitesse de chauffage doit être maintenue bien en dessous de 1 ° C / min. Une technique similaire est adoptée pour la monarsenide SMAS, mais la température de synthèse est supérieure à 1800 ° C.
Un grand nombre de composés binaires cristallins sont connus pour samarium et une de 5 ou 6 élément X du groupe 4, où X est Si, Ge, Sn, Pb, Sb ou Te, et les alliages métalliques de la forme de samarium autre grand groupe. Ils sont tous préparés par recuit de poudres mélangées des éléments correspondants. Un grand nombre des composés résultants sont non stoechiométrique et ont des compositions nominales SM a X b, où le rapport b / a varie entre 0,5 et 3.
Composés organométalliques
Samarium forme un Sm cyclopentadiénide (C 5 H 5) 3 et ses chloroderivatives Sm (C 5 H 5) 2 Cl et Sm (C 5 H 5) Cl 2. Ils sont préparés par réaction avec le trichlorure de samarium NaCl 5 H 5 dans tétrahydrofurane. Contrairement à la plupart des autres cyclopentadienides lanthanides, en Sm (C 5 H 5) 3 C 5 H certains 5 anneaux combler les uns les autres en formant une ou des arêtes annulaires η de vertex 2 vers un autre atome de samarium voisins, en créant ainsi des chaînes polymères. Le chloroderivative Sm (C 5 H 5) 2 Cl a une structure dimère, qui est plus précisément exprimée en (η 5 -C 5 H 5) 2 Sm (μ-Cl) 2 (η 5 -C 5 H 5) 2. Là, les ponts de chlore peuvent être remplacés, par exemple, par l'iode, l'hydrogène ou des atomes d'azote ou par des groupes CN.
Le (C 5 H 5) - ion dans cyclopentadienides de samarium peut être remplacé par le indenide (C 9 H 7) - ou cyclooctatetraenide (C 8 H 8) 2- anneau, résultant en Sm (C 9 H 7) 3 ou KSm (η 8 -C 8 H 8) 2. Ce dernier composé a une structure similaire à celle de la Uranocène. Il existe également un cyclopentadiénure de samarium divalent, Sm (C 5 H 5) 2 - d'un solide qui se sublime à environ 85 ° C. Contrairement à ferrocène, les C 5 H 5 anneaux Sm (C 5 H 5) 2 ne sont pas parallèles, mais sont inclinées par 40 °.
Alkyles et aryles de samarium sont obtenus grâce à une réaction de métathèse dans du tétrahydrofuranne ou de l'éther :
- SmCl 3 + 3 LiR → SmR 3 + 3 LiCl
- Sm (OR) 3 + 3 LiCH (SiMe 3) 2 → Sm {CH (SiMe 3) 2} 3 + 3 LiOR
Ici, R est un groupe hydrocarboné et Me signifie un groupe méthyle.
Isotopes
D'origine naturelle a une samarium radioactivité de 128 Bq / g. Il est composé de quatre stables isotopes : 144 Sm, 150 Sm, 152 et 154 Sm Sm, et trois très long terme radio-isotopes, 147 Sm (demi-vie t ½ = 1,06 × 10 11 années), 148 Sm (7 × 10 15 années) et 149 Sm (> 2 x 10 15 années), avec 152 Sm étant le plus abondant ( abondance naturelle de 26,75%). 149 Sm est répertorié par diverses sources que soit isotopes stables ou radioactifs.
Les isotopes à vie longue, 146 Sm, 147 Sm, et 148 Sm, principalement désintégration par émission de particules alpha à isotopes de néodyme . Briquet isotopes instables de samarium principalement par désintégration capture d'électrons aux isotopes de prométhium , tandis que les plus lourds se convertir par désintégration bêta isotopes de l'europium .
Le la désintégration alpha de 147 Sm à 143 Nd avec une demi-vie de 1,06 × 10 11 années servent à samarium-néodyme dating
Les demi-vies de 151 Sm et 145 Sm ya 90 ans et 340 jours, respectivement. Tout le reste des radio-isotopes ont des demi-vies qui sont inférieures à 2 jours, et la majorité d'entre eux ont des demi-vies qui sont moins de 48 secondes. Samarium a aussi cinq isomères nucléaires avec l'être le plus stable 141m Sm ( demi-vie 22,6 minutes), 143m1 Sm (t ½ = 66 secondes) et 139m Sm (t ½ = 10,7 secondes).
Histoire

Détection d'éléments de samarium et connexes a été annoncé par plusieurs scientifiques dans la seconde moitié du 19ème siècle; Cependant, la plupart des sources donnent la priorité à la française chimiste Paul Émile Lecoq de Boisbaudran. Boisbaudran isolé oxyde et / ou hydroxyde de samarium dans Paris en 1879 du minéral samarskite ((Y, Ce, U, Fe) 3 (Nb, Ta, Ti) 5 O 16) et a identifié un nouvel élément dans ce moyen de lignes d'absorption optique tranchants. Le chimiste suisse Marc Delafontaine a annoncé un nouvel élément decipium (du latin : decipiens signifie «trompeuse, fallacieuse") en 1878, mais plus tard dans 1880-1881 démontré que ce était un mélange de plusieurs éléments, l'un étant identique au samarium du Boisbaudran. Bien samarskite a été découvert dans la région russe de distance Oural, à la fin des années 1870, ses dépôts avaient été repérés dans d'autres endroits qui font le minéral disponible pour de nombreux chercheurs. En particulier, il a été constaté que le samarium isolé par Boisbaudran était impur et contient également quantité comparable de l'europium . L'élément pur a été produit seulement en 1901 par Eugène Anatole Demarçay.
Boisbaudran nommé son élément Samarie après la samarskite minérale, qui à son tour honoré Vasili Samarsky-Bykhovets (1803-1870). Samarsky-Bykhovets, en tant que chef d'état-major de la Russie l'accès Corps des ingénieurs des mines, avait accordé pour deux minéralogistes allemands, les frères Gustav Rose et Heinrich Rose, pour étudier les échantillons de minéraux de l'Oural. En ce sens, le samarium a été le premier élément chimique à être nommé d'après une personne. Plus tard le nom samaria utilisés par Boisbaudran a été transformé en samarium, de se conformer aux autres noms d'éléments, et la Samarie nos jours est parfois utilisé pour désigner l'oxyde de samarium, par analogie avec l'oxyde d'yttrium, la zircone, de l'alumine , l'oxyde de cérium, Holmia, etc. Le symbole Sm a été suggéré pour le samarium; Cependant une alternative Sa a été fréquemment utilisé à la place jusqu'à ce que les années 1920.
Avant l'avènement de technologie de séparation par échange d'ions dans les années 1950, le samarium ne avait pas les utilisations commerciales sous forme pure. Cependant, un sous-produit de la purification par cristallisation fractionnée de néodyme est un mélange de samarium et le gadolinium qui a acquis le nom de "Lindsay Mix" après que l'entreprise qui l'a fait. Ce matériau est considéré comme ayant été utilisé pour le nucléaire des barres de contrôle dans certains des premiers réacteurs nucléaires. Aujourd'hui, un produit de base similaire a le nom "samarium-europium- gadolinium "(SEG) concentré. Il est préparé par extraction par solvant à partir de mélanges les lanthanides isolés à partir de bastnäsite (ou monazite). Étant donné que les lanthanides lourds ont la plus grande affinité pour le solvant utilisé, ils sont facilement extrait de la masse en utilisant des proportions relativement faibles de solvant. Pas tous les producteurs de terres rares qui traitent bastnäsite faire sur une échelle suffisamment grande pour continuer en avant avec la séparation des composants du SEG, qui fait généralement jusqu'à seulement un ou deux pour cent du minerai d'origine. Ces producteurs seront donc font SEG en vue de le commercialiser aux processeurs spécialisés. De cette manière, la teneur en europium de valeur du minerai est recueilli pour une utilisation dans fabrication luminophore. Purification samarium suit le retrait de la europium. À partir de 2012, être en surplus, l'oxyde de samarium est moins cher à une échelle commerciale que son abondance relative dans le minerai pourrait suggérer.
Présence et la production

Avec la concentration moyenne d'environ 8 parties par million (ppm), le samarium est l'élément le plus abondant dans la croûte 40e de la Terre. Ce est la cinquième lanthanides plus abondant et est plus commun que tel élément que l'étain. Samarium concentration dans les sols varie entre 2 et 23 ppm, et les océans contient environ 0,5 à 0,8 parties par billion. Répartition de samarium dans les sols dépend fortement de l'état chimique et est très inhomogène: dans des sols sablonneux, la concentration de samarium est d'environ 200 fois supérieure à la surface des particules du sol que dans l'eau emprisonnée entre eux, et ce rapport peut dépasser 1000 dans les argiles.
Samarium ne est pas trouvé libre dans la nature, mais, comme d'autres éléments des terres rares, est contenue dans de nombreux minéraux, y compris monazite, bastnäsite, cerite, gadolinite et samarskite; monazite (samarium dans lequel se produit à des concentrations allant jusqu'à 2,8%) et bastnäsite sont principalement utilisés en tant que sources commerciales. les ressources mondiales de samarium sont estimés à deux millions tonnes; ils sont pour la plupart situés en Chine, Etats-Unis, le Brésil, l'Inde, le Sri Lanka et l'Australie, et la production annuelle est d'environ 700 tonnes. rapports de production du pays sont habituellement donnés pour tous les métaux des terres rares combinés. De loin, la Chine a la plus grande production avec 120 000 tonnes extraites par an; il est suivi par les Etats-Unis (environ 5000 tonnes) et en Inde (2700 tonnes). Samarium est généralement vendu sous forme d'oxyde, qui, au prix d'environ 30 USD / kg est l'un des moins chers oxydes de lanthanides. Alors que mischmétal - un mélange de métaux de terres rares contenant environ 1% de samarium - a longtemps été utilisé, le samarium relativement pur a été isolé récemment, par l'intermédiaire processus d'échange d'ions, techniques d'extraction par solvant, et dépôt électrochimique. Le métal est souvent préparée par électrolyse d'un mélange fondu de samarium (III) avec du chlorure de chlorure de sodium ou chlorure de calcium . Samarium peut également être obtenu par réduction avec son oxyde de lanthane . Le produit est ensuite distillé pour séparer le samarium (point d'ébullition 1794 ° C) et le lanthane (pb 3464 ° C).
Samarium-151 est produit dans la fission nucléaire de l'uranium avec un rendement d'environ 0,4% du nombre total d'événements de fission. Il est également synthétisée sur capture de neutrons par le samarium-149, qui est ajouté à la tiges de réacteurs nucléaires de commande. Par conséquent, le samarium-151 est présent dans passé combustible nucléaire et des déchets radioactifs.
Applications

Une des applications les plus importantes de samarium est en des aimants samarium-cobalt, qui ont une composition nominale de SmCo 5 ou Sm 2 Co 17. Ils ont une forte aimantation permanente, qui est d'environ 10 000 fois celle du fer et est la deuxième à celle de aimants néodyme. Cependant, les aimants à base de samarium-ont une résistance élevée à la démagnétisation, car ils sont stables à des températures supérieures à 700 ° C (cf. 300-400 ° C pour les aimants au néodyme). Ces aimants se trouvent dans les petits moteurs, des écouteurs, haut de gamme magnétique micros pour guitares et instruments de musique connexes. Par exemple, ils sont utilisés dans les moteurs d'un énergie solaire avion électrique Solaire Challenger et dans le Samarium cobalt Noiseless guitare électrique et basse électrique.
Une autre application importante de samarium et de ses composés est comme catalyseur et réactif chimique. Catalyseurs samarium aider décomposition de matières plastiques, déchloration de polluants tels que des biphényles polychlorés (PCB), ainsi que la déshydratation et déshydrogénation de l'éthanol. Le samarium (III) triflate (Sm (OTf) 3, ce est-Sm (CF 3 SO 3) 3) est l'un des plus efficaces Catalyseurs acides de Lewis pour la promotion d'un halogène Réaction de Friedel-Crafts avec des alcènes. Samarium (II) iodure est un agent très commun et réduire couplage la synthèse organique, par exemple dans le réactions desulfonylation; annulation; Danishefsky, Kuwajima, Mukaiyama et Holton Taxol synthèses totales; synthèse totale de la strychnine; Réaction de Barbier et autres réductions avec le samarium (II) d'iodure.
Dans sa forme oxydée d'habitude, le samarium est ajouté à la céramique et les verres où il augmente l'absorption de la lumière infrarouge. Comme une partie (mineure) de mischmétal, le samarium se trouve dans " silex "du dispositif d'allumage d'un grand nombre des briquets et des torches.

Radioactifs du samarium-153 est un émetteur bêta, avec une demi-vie de 46,3 heures. Il est utilisé pour tuer les cellules cancéreuses dans le traitement du cancer du poumon , cancer de la prostate, cancer du sein et ostéosarcome. A cet effet, le samarium-153 est chélaté avec de l'éthylène diamine tétraméthylène phosphonate ( EDTMP) et injecté par voie intraveineuse. La chelation empêche l'accumulation de samarium radioactif dans le corps qui se traduirait par une irradiation excessive et la génération de nouvelles cellules cancéreuses. Le médicament correspondant a plusieurs noms, y compris samarium (Sm 153) lexidronam et son nom commercial est Quadramet.
Samarium-149 a section haute pour capture de neutrons (41 000 granges) et est par conséquent utilisé dans les barres de commande de les réacteurs nucléaires. Son avantage par rapport aux matériaux concurrents, tels que le bore ou le cadmium, est la stabilité de l'absorption - la plupart des produits de fusion et de décomposition du samarium-149 sont d'autres isotopes d'samarium sont aussi bons que des absorbeurs de neutrons. Par exemple, les sections de samarium-151 est 15 000 granges, il est de l'ordre de centaines de granges pour le samarium-150, 152, 153, et 6800 est granges pour naturelle (mixte isotopique) samarium. Parmi les produits de désintégration dans un réacteur nucléaire, le samarium-149 est considérée comme la deuxième plus importante pour la conception et le fonctionnement du réacteur après xénon-135.
Applications non commerciales et potentiels
Dopé au samarium cristaux de fluorure de calcium ont été utilisés en tant que milieu actif à l'un des premiers lasers à l'état solide conçu et construit par Peter Sorokin (co-inventeur de la laser à colorant) et Mirek Stevenson à IBM laboratoires de recherche au début de 1961. Ce laser de samarium émis des impulsions de lumière rouge à 708,5 nm. Il a dû être refroidi par de l'hélium liquide et donc n'a pas trouvé des applications pratiques.
Un autre laser à base de samarium-est devenu le premier saturé Laser à rayons X fonctionnant à des longueurs d'onde plus courtes que 10 nanomètres. Il a fourni des impulsions de 50 picosecondes à 7,3 et 6,8 nm pour des applications dans holographie, haute résolution microscopie d'échantillons biologiques, déflectométrie, interférométrie et radiographie des plasmas denses liés à la fusion et le confinement de l'astrophysique . Fonctionnement saturé signifie que la puissance maximale possible a été extraite du milieu laser, résultant de l'énergie de crête élevée de 0,3 mJ. Le milieu actif a été produit par le plasma samarium irradier verre de samarium-revêtue d'un infrarouge pulsé Laser Nd-verre (longueur d'onde ~ 1,05 um).
Le changement de résistivité électrique dans monochalcogénures de samarium peut être utilisé dans un capteur de pression ou dans un dispositif de mémoire déclenché entre une faible résistance et l'état de résistance élevée par une pression externe, et ces dispositifs sont mis au point dans le commerce. Monosulfure de Samarium génère également une tension électrique lors d'un chauffage modéré à environ 150 ° C qui peut être appliquée en convertisseurs de puissance thermoélectrique.
L'analyse des concentrations relatives des isotopes samarium et le néodyme 147 Sm, 144 et 143 Nd Nd permet la détermination de l'âge et de l'origine des roches et des météorites samarium-néodyme datation. Les deux éléments sont des lanthanides et ont des propriétés physiques et chimiques très similaires. Par conséquent, Sm-Nd datation est soit insensible à cloisonnement des éléments marqueurs pendant des processus géologiques ou telle séparation peut ainsi être comprise et modélisée à partir de la rayons ioniques des éléments concernés.
Les questions de santé
Samarium métallique n'a pas de rôle biologique dans le corps humain. Ses sels stimulent le métabolisme, mais il est difficile de savoir si ce est l'effet de samarium ou d'autres lanthanides présents avec elle. La quantité totale de samarium chez l'adulte est d'environ 50 microgrammes, principalement dans le foie et les reins et avec environ 8 microgrammes par litre étant dissous dans le sang. Samarium ne est pas absorbé par les plantes à une concentration mesurable et ne est donc normalement pas une partie de l'alimentation humaine. Cependant, quelques plantes et légumes peuvent contenir jusqu'à 1 partie par million de samarium. Les sels insolubles de samarium sont non toxiques et solubles sont ceux que légèrement toxique.
Lorsqu'il est ingéré, seulement environ 0,05% de sels de samarium est absorbé dans la circulation sanguine et le reste est excrété. Du sang, environ 45% va vers le foie et 45% est déposée sur la surface de l'os où il reste pendant environ 10 ans; le solde de 10% est excrété.
