
Plutônio
Informações de fundo
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. Com SOS Children você pode escolher para patrocinar crianças em mais de cem países
| Plutônio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
94 Pu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
branco prateado, manchando de cinza escuro no ar  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | plutônio, Pu, 94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / p l u t oʊ n Eu ə m / ploo- TOH -nee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | actinide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | (244) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 6 7s 2 2, 8, 18, 32, 24, 8, 2  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Glenn T. Seaborg, Arthur Wahl, Joseph W. Kennedy, Edwin McMillan (1940-1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 19,816 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 16,63 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 912,5 K , 639,4 ° C, 1182.9 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3505 K, 3228 ° C, 5842 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 2.82 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 333,5 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 35,5 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 8, 7, 6, 5, 4, 3, 2, 1 ( óxido anfotérico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,28 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 584,7 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 159 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 187 ± 13:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | monoclinic  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (0 ° C) 1,460 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 6,74 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 46,7 uM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | 2260 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 96 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-07-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de plutônio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O plutónio é um transuranic radioativo elemento químico com o símbolo Pu e número atômico 94. É uma actinide de metal de aparência cinza-prateado que escurece quando exposto ao ar, e formação de um revestimento sem brilho quando oxidado. O elemento normalmente exibe seis formas alotrópicas e quatro estados de oxidação . Ela reage com o carbono , halogéneos , nitrogénio , e silício . Quando exposto ao ar húmido, ele forma óxidos e hidretos que expandem a amostra até 70% em volume, o que, por sua vez descamar como um pó que pode inflamar-se espontaneamente. É radioactivo e pode acumular-se no ossos. Estas propriedades tornam o tratamento de plutónio perigoso.
O plutónio é o mais pesado elemento primordial em virtude da sua mais estável isótopo, plutónio-244, cujo semi-vida de cerca de 80 milhões de anos, é apenas o tempo suficiente para o elemento a ser encontrado em pequenas quantidades na natureza. O plutónio é na maior parte um subproduto de reações nucleares em reatores, onde alguns dos nêutrons liberados pela fissão processo de converter o urânio 238 núcleos em plutônio.
Tanto plutônio-239 e plutónio 241 são físsil, o que significa que eles podem sustentar uma reação nuclear em cadeia, levando a aplicações em armas nucleares e reatores nucleares. O plutónio-240 exibe uma elevada taxa de fissão espontânea, elevando o fluxo de nêutrons de qualquer amostra que o contenham. A presença de plutônio-240 limita a usabilidade de uma amostra para armas ou combustível de reator, e determina a sua grau.
Plutônio-238 tem uma meia-vida de 88 anos e emite partículas alfa. É uma fonte de calor em geradores termoelétricos de radioisótopos, que são utilizados para alimentar alguns nave espacial. Isótopos de plutónio são caros e inconveniente para separar, de modo particular, os isótopos são geralmente fabricados em reatores especializados.
Uma equipe liderada por Glenn T. Seaborg e Edwin McMillan no University of California, Berkeley laboratório sintetizado pela primeira vez plutônio em 1940 bombardeando urânio-238 com deuterons. Vestígios de plutônio foram descobertos na natureza. A produção de plutónio em quantidades úteis para o primeiro tempo foi uma parte importante do Projeto Manhattan durante a II Guerra Mundial , que desenvolveu as primeiras bombas atômicas. O primeiro teste nuclear, " Trinity "(Julho de 1945), ea segunda bomba atômica usada para destruir uma cidade ( Nagasaki, Japão, em agosto de 1945), " Fat Man ", ambos tinham núcleos de plutônio-239. Experimentos de radiação humanos que estudam plutônio foram conduzidos sem consentimento informado, e vários acidentes de criticidade, alguns letal, ocorreu durante e depois da guerra. Alienação de resíduos de plutónio usinas nucleares e armas nucleares desmanteladas construídos durante a Guerra Fria é um proliferação nuclear e preocupação ambiental. Outras fontes de plutónio no ambiente são precipitação a partir de inúmeros testes nucleares acima do solo (agora banido).
Características
Propriedades físicas
Plutônio, como a maioria dos metais, tem uma aparência prateada brilhante no início, bem como o níquel , mas oxida muito rapidamente para um cinza maçante, embora amarelo e verde oliva também são relatados. À temperatura ambiente plutónio é na sua forma α (alpha). Esta, a forma estrutural mais comum do elemento ( allotrope ), é quase tão duro e quebradiço como ferro fundido cinzento, a menos que seja misturado com outros metais para torná-lo macio e dúctil. Ao contrário a maioria dos metais, não é um bom condutor de calor ou electricidade. Ele tem um baixo ponto de fusão (640 ° C) e uma invulgarmente elevado ponto de ebulição (3228 ° C).
Decaimento alfa, a libertação de uma alta energia de hélio núcleo, é a forma mais comum de decaimento radioativo para o plutónio. Uma massa de 5 kg de 239 Pu contém cerca de 12,5 × 10 24 átomos. Com uma meia-vida de 24.100 anos, cerca de 11,5 x 10 12 dos seus átomos de decair cada segundo, emitindo um 5,157 MeV de partículas alfa. Isso equivale a 9,68 watts de potência. O calor produzido pela desaceleração destas partículas alfa torna quente ao toque.
A resistividade é uma medida de quão fortemente um material se opõe ao fluxo de corrente elétrica. A resistividade de plutônio à temperatura ambiente é muito alta para um metal, e torna-se ainda maior com temperaturas mais baixas, o que é incomum para os metais. Esta tendência continua para baixo para 100 K , abaixo do qual a resistividade diminui rapidamente para amostras frescas. Resistividade em seguida começa a aumentar com o tempo, em cerca de 20 K, devido aos danos de radiação, com a taxa em função da composição isotópica da amostra.
Por causa da auto-irradiação, uma amostra de fadigas de plutónio em toda a sua estrutura cristalina, ou seja, o arranjo ordenado dos seus átomos se torna perturbado por radiação com o tempo. Auto-irradiação também pode levar a recozimento que contraria alguns efeitos da fadiga como o aumento da temperatura acima de 100 K.
Diferentemente da maioria dos materiais, os aumentos de plutônio na densidade quando derrete, por 2,5%, mas o metal líquido exibe uma diminuição na densidade linear com a temperatura. Perto do ponto de fusão, o plutónio líquido tem também muito alta viscosidade e tensão superficial , em comparação com outros metais.
Allotropes
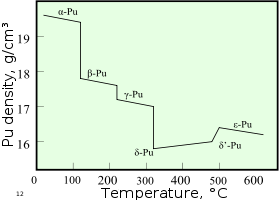
O plutónio tem normalmente seis formas alotrópicas e forma uma sétima (zeta, ζ) a uma temperatura elevada dentro de um intervalo de pressão limitada. Estes allotropes, que são diferentes modificações estruturais ou formas de um elemento, tem muito semelhante energias internas mas variando significativamente densidades e estruturas cristalinas. Isso faz com que o plutónio muito sensível às mudanças de temperatura, pressão, ou química, e permite variações de volume dramáticas seguintes transições de fase de uma forma alotrópica para outro. As densidades das diferentes formas alotrópicas variar de 16,00 g / cm 3-19,86 g / cm 3.
A presença destas formas alotrópicas torna muitas usinagem plutónio muito difícil, uma vez que muda de estado muito facilmente. Por exemplo, existe a forma α à temperatura ambiente em plutónio não ligado. Ele tem características semelhantes a usinagem ferro fundido mas muda para o plástico e forma maleável β (beta) a temperaturas ligeiramente mais elevadas. As razões para o diagrama de fases complicadas não são totalmente compreendidos. A forma α tem uma baixa simetria estrutura monoclínica, daí a sua fragilidade, tração, compressão, e baixa condutividade térmica.
O plutónio na forma δ existe normalmente na gama de 310 ° C a 452 ° C, mas é estável à temperatura ambiente quando ligado com uma pequena percentagem de gálio , de alumínio , ou de cério , aumentando a trabalhabilidade e que lhe permita ser soldado . A forma de delta tem caráter mais típico metálico, e é mais ou menos tão forte e maleável como o alumínio. Em armas de fissão, o explosivo ondas de choque utilizadas para comprimir um núcleo de plutónio também irá provocar uma transição de fase do plutónio delta habitual para a forma alfa mais denso, ajudando significativamente para atingir supercriticalidade. A fase ε, o maior allotrope sólido temperatura, exibe anormalmente alta atômica auto-difusão em comparação com outros elementos.
Fissão nuclear

O plutónio é um radioativo actinide de metal cujo isótopo , plutônio-239, é um dos três principais isótopos físseis ( urânio-233 e urânio-235 são os outros dois); plutônio-241 também é altamente físsil. Para ser considerado físsil, um isótopo do núcleo atômico deve ser capaz de quebrar ou fissão quando atingido por um retardar nêutrons em movimento e liberar nêutrons adicionais suficientes para sustentar a reação nuclear em cadeia, dividindo mais núcleos.
Pure plutônio-239 pode ter um factor de multiplicação (FEP k) maior do que um, o que significa que, se o metal está presente em quantidade suficiente e com uma geometria apropriada (por exemplo, uma esfera de tamanho suficiente), ele pode formar um massa crítica. Durante a fissão, uma fracção do energia, que mantém um núcleo em conjunto vinculativo, é lançado como uma grande quantidade de energia eletromagnética e cinética (muito do último sendo rapidamente convertida em energia térmica). Fissão de um quilograma de plutônio-239 pode produzir uma explosão equivalente a 21 mil toneladas de TNT. É esta energia que faz com que o plutônio-239 útil em armas nucleares e reactores.
A presença do isótopo plutônio-240 em uma amostra limita seu potencial bomba nuclear, como o plutônio-240 tem um relativamente elevado taxa de fissão espontânea (~ 440 fissões por segundo por grama-mais de 1.000 nêutrons por segundo por grama), elevando os níveis de fundo de nêutrons e aumentando assim o risco de predetonation. O plutónio é identificado como quer de armas, tipo de combustível, ou em reactores de energia com base no percentual de plutônio-240 que ele contém. Plutônio para armas contém menos de 7% de plutônio-240. Plutônio combustível contém de 7% para menos de 19%, e em reactores de energia contém 19% ou mais de plutônio-240. Supergrade plutónio, com menos de 4% do plutónio-240, é usada em Armas da Marinha dos EUA armazenadas em proximidade para enviar e tripulações de submarinos, devido à sua radioactividade inferior. O isótopo plutônio-238 não é físsil, mas pode sofrer fissão nuclear facilmente com nêutrons rápidos, bem como decaimento alfa.
Isótopos e síntese
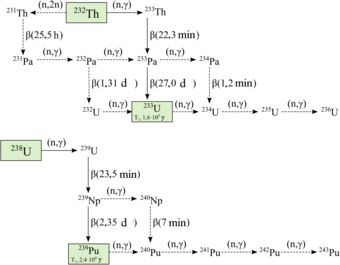
Vinte isótopos radioactivos de plutónio foram caracterizados. A mais longa duração são plutônio-244, com meia-vida de 80,8 milhões ano, o plutônio-242, com meia-vida de 373.300 anos, e plutônio-239, com meia-vida de 24.110 anos. Todos os demais isótopos radioativos apresentam meias-vidas abaixo de 7.000 anos. Este elemento apresenta também oito estados metaestáveis, embora nenhum são estáveis e todos têm meia-vida inferior a um segundo.
Os isótopos de plutônio em faixa número de massa de 228 para 247. A principal modos de decaimento de isótopos com números de massa mais baixos do que o isótopo mais estável, o plutônio-244, são fissão espontânea e emissão α, principalmente a formação de urânio (92 prótons ) e neptunium (93 prótons) isótopos como produtos de decaimento (negligenciando a vasta gama de núcleos filhos criados por processos de fissão). O principal modo de decaimento de isótopos com números de massa maior do que o plutônio-244 é emissão β, principalmente formando amerício (95 prótons) isótopos como produtos de decaimento. Plutônio-241 é a isótopo pai do série de decaimento neptunium, decaindo para amerício-241 via β ou emissão de elétrons.
Plutónio 238 e 239 são os isótopos mais amplamente sintetizados. O plutónio-239 é sintetizado através da reacção seguinte usando o urânio (U) e neutrões (n), através de decaimento beta (β -) com Neptúnio (Np) como um intermediário:
Nêutrons da fissão do urânio-235 são capturado por urânio 238 núcleos para formar urânio-239; um decaimento beta converte um nêutron em um próton para formar Np-239 (meia-vida 2,36 dias) e mais um decaimento beta forma plutônio-239. Trabalhadores no Projeto Ligas tubo havia previsto essa reação teoricamente em 1940.
Plutônio-238 é sintetizado bombardeando o urânio-238 com deuterons (D, os núcleos de pesados de hidrogênio ) na seguinte reacção:
Neste processo, um deuteron bater urânio-238 produz dois nêutrons e neptúnio-238, que decai espontaneamente emitindo partículas beta negativos para formar o plutônio-238.
Propriedades de calor e de fissão Decay
Isótopos de plutónio sofrem decaimento radioativo, que produz calor de decaimento. Isótopos diferentes produzem diferentes quantidades de calor por massa. O calor de decaimento é geralmente listado como watt / kg, ou miliwatt / grama. Em caso de pedaços maiores de plutónio (por exemplo, um poço de arma) e remoção de calor inadequada resultante do auto-aquecimento pode ser significativo. Todos os isótopos produzir gama fraco em decadência.
| Isótopo | Modo de decaimento | Meia-vida (anos) | Calor de decaimento (W / kg) | Neutrões de fissão espontânea (1 / (g-s)) | Comente |
|---|---|---|---|---|---|
| 238 Pu | alfa para 234 U | 87,74 | 560 | 2600 | Muito alto calor de decaimento. Mesmo em pequenas quantidades, podem provocar o auto-aquecimento significativo. Usado por si próprio em geradores termoelétricos de radioisótopos. |
| 239 Pu | alfa para 235 U | 24100 | 1.9 | 0,022 | O principal isótopo físsil em uso. |
| 240 Pu | alfa para 236 U, fissão espontânea | 6560 | 6.8 | 910 | A principal impureza em amostras do isótopo 239 Pu. O plutônio é geralmente listado como percentual de 240 Pu. Alto dificulta fissão espontânea usar em armas nucleares. |
| 241 Pu | beta-menos, a 241 Am | 14,4 | 4.2 | 0,049 | Decai para amerício-241; seu acúmulo apresenta um perigo de radiação em amostras mais antigas. |
| 242 Pu | alfa para 238 L | 376000 | 0,1 | 1700 |
Amerício-241, o produto de decaimento do plutónio-241, tem meia-vida de 430 anos, 1,2 fissões espontâneas por grama por segundo, e decadência de calor de 114 watts por quilograma. Como o seu decaimento produz raios gama altamente penetrantes, sua presença no plutônio, determinada pela concentração original de plutônio-241 e a idade da amostra, aumenta a exposição à radiação de estruturas adjacentes e pessoal.
Compostos e química

À temperatura ambiente, de plutónio puro é prateado na cor, mas ganha um manchar quando oxidados. O elemento exibe quatro iônicos comuns estados de oxidação em solução aquosa e uma rara:
- Pu (III), como Pu 3+ (azul lavanda)
- Pu (IV), como Pu 4+ (marrom amarelo)
- Pu (V), como può +
2 (rosa claro) - Pu (VI), como può 2+
2 (rosa) - Pu (VII), como può 3-
5 (verde) -a ion heptavalente é rara
A cor apresentada por soluções de plutónio depende tanto do estado de oxidação e a natureza do ácido anião . É o anião do ácido que influencia o grau de átomos de complexação-how conectar a um centro de átomo-das espécies de plutônio.
Plutónio metálico é produzido por reacção de tetrafluoreto de plutónio com bário , cálcio ou lítio a 1200 ° C. Ele é atacado por ácidos , de oxigénio e de vapor mas não pela álcalis e dissolve-se facilmente em concentrado clorídrico , iodídrico e perclórico. O metal fundido deve ser mantida num ou um vácuo atmosfera inerte para evitar a reacção com o ar. A 135 ° C, o metal vai inflamar em ar e irá explodir se colocado em tetracloreto de carbono .


O plutónio é um metal reativo. No ar húmido ou húmido árgon , o metal oxida rapidamente, produzindo uma mistura de óxidos e hidretos. Se o metal é exposto o tempo suficiente para uma quantidade limitada de vapor de água, uma superfície de revestimento em pó de Può 2 é formada. Também é formado hidreto de plutônio, mas um excesso de formas de vapor de água única può 2.
Com este revestimento, o metal é pirofórico, o que significa que pode inflamar espontaneamente, assim plutónio metálico é normalmente manuseado numa atmosfera inerte, seca de azoto ou de árgon. Oxigénio retarda os efeitos da humidade e actua como um agente passivador.
Plutônio mostra enormes, e reversíveis taxas, reação com hidrogênio puro, formando hidreto de plutônio. Ele também reage prontamente com o oxigênio, formando può e può 2, bem como óxidos intermédios; óxido de plutônio preenche 40% mais volume do que de plutónio metálico. O plutónio dá origem a compostos tais como pux 3 em que X pode ser F, Cl, Br ou I quando reage com os átomos de halogénio ; PUF 4 também é visto. Os seguintes oxi-halogenetos são observados: PuOCl, PuOBr e puoi. Ele vai reagir com o carbono para formar PUC, nitrogênio para formar trocadilho e silício para formar PUSI 2.
Os cadinhos utilizados para conter plutónio precisa de ser capaz de suportar o seu fortemente reduzindo propriedades. Metais refractários, tais como o tântalo e tungsténio juntamente com os óxidos mais estáveis, boretos, carbonetos, e nitretos silicietos pode tolerar isso. Derretendo em um forno eléctrico de arco pode ser utilizado para produzir pequenos lingotes de metal sem a necessidade de um cadinho.
O cério é usado como um simulador de plutónio química para o desenvolvimento de contenção, extracção, e outras tecnologias.
Estrutura eletrônica
O plutónio é um elemento em que o 5f electrões são a fronteira de transição entre deslocalizado e localizada; é, portanto, considerado um dos elementos mais complexos. O comportamento anômalo de plutónio é causada por sua estrutura eletrônica. A diferença de energia entre as subcamadas 6d e 5f é muito baixo. O tamanho do invólucro 5f é apenas o suficiente para permitir que os electrões para formar ligações dentro da rede, em muito o limite entre localizada e comportamento de aderência. A proximidade dos níveis de energia leva a múltiplas configurações de elétrons de baixa energia com perto de níveis de energia iguais. Isto leva a competir 5F n 7s 2 e 5-F n-1 2 7s 6d uma configurações, o que provoca a complexidade do seu comportamento químico. A natureza altamente direcional de orbitais 5f é responsável por ligações covalentes direcionais em moléculas e complexos de plutónio.
Alloys
Plutônio pode formar ligas e compostos intermédios com a maioria dos outros metais. As excepções incluem lítio , sódio , potássio , rubídio e césio dos metais alcalinos ; e de magnésio , cálcio , estrôncio e bário dos metais alcalino-terrosos ; e európio e itérbio do metais de terras raras. Excepções parciais incluem os metais refractários crómio , molibdénio , nióbio , tântalo , e de tungsténio , que são solúveis no líquido de plutónio, mas insolúvel ou apenas ligeiramente solúvel em plutónio sólido. gálio , alumínio , amerício , escândio e cério pode estabilizar a fase δ de plutónio para a temperatura ambiente. Silício , índio , zinco e zircónio permitir a formação de estado metastable δ quando rapidamente resfriado. Quantidades elevadas de háfnio , hólmio e tálio também permite reter alguma da fase δ à temperatura ambiente. Neptúnio é o único elemento que pode estabilizar a fase α a temperaturas mais elevadas.
Ligas de plutónio pode ser produzido por adição de um metal fundido para plutónio. Se o metal de liga é suficientemente redutiva, o plutónio podem ser adicionados na forma de óxidos ou halogenetos. As ligas de fase δ plutônio-gálio e plutônio-alumínio são produzidos pela adição de plutónio (III), fluoreto de gálio ou de alumínio fundido, que tem a vantagem de evitar que lidam directamente com o plutónio metálico altamente reactivo.
- Plutônio-gálio é usado para estabilizar a fase δ de plutônio, evitando a fase α e questões relacionadas δ-α. Seu principal uso é na poços de implosão armas nucleares.
- O plutónio-alumínio é uma alternativa para a liga de Pu-Ga. Foi considerado o elemento original para estabilização fase δ, mas a sua tendência para reagir com as partículas alfa e libertar neutrões reduz a sua utilidade para poços de armas nucleares. Liga de alumínio-plutónio pode também ser usado como um componente de combustível nuclear.
- Plutônio-gálio-cobalto liga (PuCoGa 5) é um supercondutor não convencional, mostrando supercondutividade abaixo de 18,5 kelvin , uma ordem de magnitude maior do que o maior entre sistemas de férmions pesados, e tem grande corrente crítica.
- Liga de plutónio-zircónio pode ser usado como combustível nuclear.
- Plutônio-cério e plutônio-cério-cobalto ligas são usados como combustíveis nucleares.
- Plutônio-urânio, com cerca de 15-30 mol.% De plutônio, pode ser usado como combustível nuclear para reatores reprodutores rápidos. Sua natureza pirofórica e alta susceptibilidade à corrosão para o ponto de auto-ignição ou desintegração após a exposição ao ar exigem liga com outros componentes. A adição de alumínio, carbono ou cobre não melhorou o índice de desintegração acentuadamente, zircônio e ferro ligas têm melhor resistência à corrosão, mas eles se desintegram em vários meses no ar também. A adição de titânio e / ou zircónio, aumenta significativamente o ponto de fusão da liga.
- Plutônio-urânio-titânio e de plutónio-urânio-zircônio foram investigados para uso como combustível nuclear. A adição do terceiro elemento aumenta a resistência à corrosão, reduz a inflamabilidade, e melhora a ductilidade, fabricability, força, e a expansão térmica. Plutónio-urânio-molibdénio tem a melhor resistência à corrosão, a formação de uma película protectora de óxidos, mas de titânio e de zircónio são preferidos para razões física.
- Tório-urânio-plutónio foi investigado como combustível nuclear para reatores reprodutores rápidos.
Ocorrência
Vestígios de pelo menos três isótopos de plutônio (plutônio-238, 239, e 244) pode ser encontrado na natureza. Pequenos traços de plutônio-239, alguns partes por trilhão, e sua produtos de decaimento são naturalmente encontrados em alguns minérios de concentrados de urânio, como o reator de fissão nuclear natural em Oklo, Gabão . A proporção de plutônio-239 ao urânio no Depósito de urânio Cigar Lake mina varia de 2,4 × 10 -12 a 44 × 10 -12. Mesmo quantidades menores de primordial plutónio-244 ocorrem naturalmente, devido à sua semi-vida relativamente longo, de cerca de 80 milhões de anos. Estes vestígios de 239 Pu originam da seguinte forma: Em raras ocasiões, 238 U sofre fissão espontânea, e, no processo, o núcleo emite um ou dois nêutrons livres com um pouco de energia cinética. Quando um destes neutrões atinge o núcleo de um outro átomo de U 238, que é absorvido pelo átomo, o qual torna-se 239 U. Com uma meia-vida relativamente curta, L-239 decai para Neptúnio -239 (Np 239), e, em seguida, 239 Np decai em 239 Pu.
Desde o isótopo relativamente longa vida plutônio-240 ocorre no cadeia de decaimento do plutónio-244 também deve estar presente, ainda que 10.000 vezes mais raro ainda. Finalmente, extremamente pequenas quantidades de plutônio-238, atribuído ao incrivelmente rara decaimento beta duplo de urânio-238, foram encontrados em amostras de urânio naturais.
Vestígios de plutónio são normalmente encontrados no corpo humano devido à 550 atmosférica e subaquática testes nucleares que foram realizadas, e para um pequeno número de grandes acidentes nucleares. Mais testes nucleares na atmosfera e debaixo d'água foi interrompido pelo Tratado de Proibição de Testes limitado em 1963, que foi assinado e ratificado pelo Estados Unidos , o Reino Unido , a União Soviética , e outras nações. Testes de armas nucleares atmosféricos continuado desde 1963 por nações não-tratados incluídos os de China ( bomba atômica teste acima do Deserto de Gobi em 1964, teste do hidrogênio bomba em 1967, e os testes de follow-on) e França (testes como recentemente, em 1980). Porque é deliberadamente fabricados para armas nucleares e de reatores nucleares, o plutônio-239 é o isótopo mais abundante de plutónio, de longe.
História
Descoberta
Enrico Fermi e uma equipe de cientistas da Universidade de Roma relataram que tinham descoberto elemento 94 em 1934. Fermi chamado o elemento hesperium e mencionou em sua palestra Nobel em 1938. A amostra foi, na verdade, uma mistura de bário , krypton , e outros elementos, mas isso não era conhecido na época, porque a fissão nuclear não tinha sido descoberto ainda.
O avanço com plutônio estava no Laboratório Cavendish, Cambridge por Egon e Bretscher Norman Feather. Eles perceberam que um reactor de neutrões lentos alimentado com urânio, teoricamente, produzir quantidades substanciais de plutônio-239 como um subproduto. Isto é porque U-238 absorve nêutrons lentos e forma um novo isótopo U-239. O novo núcleo do isótopo emite rapidamente um elétron através decaimento beta produzir um novo elemento com uma massa de 239 e um número atómico do núcleo 93. Este elemento de seguida também emite um electrão e torna-se um novo elemento de massa 239, mas com um número atómico 94 e uma meia-vida muito maior. Bretscher e mostrou razões Pena teoricamente possível que elemento 94 seriam prontamente 'cindíveis' por ambos os neutrões rápidos e lentos, e tinham a vantagem adicional de ser quimicamente diferente do urânio, e poderia ser facilmente separada desta.
Este novo desenvolvimento também foi confirmado em trabalhos independentes por Edwin M. McMillan e Philip Abelson em Laboratório de Radiação Berkeley também em 1940. Nicholas Kemmer da equipe de Cambridge propôs a nomes neptunium para o novo elemento 93 e plutónio para 94 por analogia com os planetas exteriores Netuno e Plutão além de Urano (urânio sendo elemento 92). Os norte-americanos por acaso sugeriu os mesmos nomes.

Plutónio (especificamente, o plutônio-238) foi produzido pela primeira vez e isolado em 14 de Dezembro de 1940, e quimicamente identificado em 23 de Fevereiro de 1941, pelo Dr. Glenn T. Seaborg, Edwin M. McMillan, JW Kennedy, e AC Wahl por deuteron bombardeio de urânio no de 60 polegadas (150 cm) no ciclotrão Universidade da Califórnia, Berkeley. No experimento de 1940, neptunium -238 foi criado directamente pelo bombardeio, mas deteriorado por a emissão beta com uma semi-vida de um pouco mais de dois dias, o que indica a formação de elemento 94.
Um trabalho documentando a descoberta foi preparado pela equipe e enviado para a revista Avaliação física em março de 1941. O documento foi retirado antes da publicação após a descoberta de que um isótopo do elemento novo (plutônio-239) poderia sofrer fissão nuclear de uma forma que pode ser útil em uma bomba atômica . Publicação foi adiada para um ano após o fim da II Guerra Mundial , devido a preocupações de segurança.
Edwin McMillan tinha nomeado recentemente o primeiro elemento transurânico após o planeta Netuno e sugeriu que elemento 94, sendo o elemento seguinte na série, ser nomeado para o que era então considerado o próximo planeta, Plutão . Seaborg originalmente considerado o nome "plutium", mas depois pensei que não soa tão bom quanto "plutônio". Ele escolheu as letras "Pu" como uma piada, que passou sem aviso prévio na tabela periódica. Os nomes alternativos considerados por Seaborg e outros foram "ultimium" ou "extremium" por causa da crença errônea de que tinham encontrado o último possível elemento na tabela periódica .
As primeiras pesquisas
A química básica de plutónio foi encontrada para se assemelhar urânio depois de alguns meses de estudo inicial. As pesquisas iniciais foi continuada no segredo Laboratório metalúrgica do Universidade de Chicago. Em 18 de Agosto de 1942, uma quantidade traço deste elemento foi isolado e medido pela primeira vez. Cerca de 50 microgramas de plutônio-239 combinados com produtos de fissão de urânio e foi produzido e apenas cerca de 1 micrograma foi isolado. Este procedimento permitiu químicos para determinar o peso atômico do novo elemento.
Em novembro de 1943 alguns plutónio trifluoreto foi reduzido para criar a primeira amostra de plutónio metálico: alguns microgramas de esferas metálicas. Plutônio suficiente foi produzida para torná-lo o primeiro sinteticamente feita elemento a ser visível a olho nu.
Também foram estudadas as propriedades nucleares de plutônio-239; pesquisadores descobriram que quando ele é atingido por um nêutron que rompe (fissões), liberando mais nêutrons e energia. Estes nêutrons pode bater outros átomos de plutônio-239 e assim por diante em um exponencialmente rápido reação em cadeia. Isto pode resultar em uma explosão grande o suficiente para destruir uma cidade suficiente de se o isótopo é concentrada para formar uma massa crítica.
Produção durante o Projeto Manhattan
Durante a Segunda Guerra Mundial, o governo dos Estados Unidos estabeleceu o Projeto Manhattan, que foi encarregado de desenvolver uma bomba atômica. Os três sites de pesquisa e de produção primária do projeto foram a instalação de produção de plutônio para o que é agora o Hanford Site, o instalações de enriquecimento de urânio de Oak Ridge, Tennessee, eo laboratório de pesquisa e design de armas, agora conhecido como Los Alamos National Laboratory.

O primeiro reator de produção de plutônio que fez-239 foi o X-10 Graphite Reactor. Ele entrou em operação em 1943 e foi construído em uma instalação em Oak Ridge, que mais tarde tornou-se o Oak Ridge National Laboratory.
Em 5 de Abril de 1944, Emilio Segrè em Los Alamos recebeu a primeira amostra de plutónio produzido em reator de Oak Ridge. Dentro de dez dias, ele descobriu que o plutónio produzido-reactor tinha uma maior concentração do isótopo plutónio-240 de plutónio produzido em ciclotrão. Plutônio-240 tem um alto taxa de fissão espontânea, elevando o nível global fundo de nêutrons da amostra de plutônio. O original arma do tipo de arma de plutónio, de codinome " Thin Man ", teve de ser abandonado, como resultado, o aumento do número de nêutrons espontâneas significava que a pré-detonação nuclear (a fizzle) seria provável.
O esforço de design arma de plutónio inteiro em Los Alamos foi logo mudou para o dispositivo de implosão mais complicado, de codinome " Fat Man ". Com uma arma de implosão, um sólido (ou, em projetos posteriores, oco) esfera de plutónio é comprimido a uma alta densidade com lentes de um explosivo tarefa tecnicamente mais difícil do que o projeto arma do tipo simples, mas necessário utilizar plutônio para fins de armamento. ( Urânio enriquecido, por outro lado, pode ser utilizado com qualquer um dos métodos.)
Construção do Hanford B Reactor, o primeiro reactor nuclear de tamanho industrial para fins de produção de material, foi concluída em março de 1945. B Reactor produziu o material físsil para as armas de plutônio usado durante a Segunda Guerra Mundial. B, D e F eram os reactores iniciais construídos em Hanford, e seis reatores de produção de plutônio adicionais foram construídas mais tarde no local.
Em 2004, um cofre foi descoberto durante as escavações de uma vala sepultamento no Instalação nuclear de Hanford. Dentro do cofre havia vários itens, incluindo uma grande garrafa de vidro contendo uma suspensão esbranquiçada que foi posteriormente identificada como a mais antiga amostra de plutônio para armas conhecidas. Análise isotópica por Pacific Northwest National Laboratory indicou que o plutónio na garrafa foi fabricado na X-10 no reactor Oak Ridge durante 1944.
Trindade e Fat Man bombas atômicas
O primeiro teste da bomba atômica, de codinome "Trinity" e detonou em 16 de julho de 1945, perto de Alamogordo, Novo México, usado plutónio como material físsil. O projeto implosão de " gadget ", como o dispositivo de Trindade era o nome de código, usado lentes de explosivos convencionais para comprimir uma esfera de plutônio em uma massa supercrítica, que foi simultaneamente regado com nêutrons do "Urchin", um iniciador feito de polônio e berílio ( fonte de nêutrons: (Α, n) reacção). Juntos, estes assegurada uma reação em cadeia em fuga e explosão. A arma global pesava mais de 4 toneladas, embora tenha utilizado apenas 6,2 kg de plutônio em seu núcleo.Cerca de 20% do plutónio utilizado na arma Trinity foram submetidos a fissão, resultando numa explosão com uma energia equivalente a cerca de 20.000toneladas de TNT.
Um projeto idêntico foi usado no "Fat Man "bomba atômica lançada sobreNagasaki,Japão, em 9 de agosto de 1945, matando 70.000 pessoas e ferindo outras 100.000. O " Little Boy "bomba lançada sobreHiroshima, três dias antes utilizadourânio-235, não plutónio . Japão capitulou em 15 de agosto ao generalDouglas MacArthur. Somente após o anúncio das primeiras bombas atómicas foi a existência de plutónio tornado público.
Utilização Guerra Fria e resíduos
Grandes estoques de plutônio para armas foram construídas tanto pela União Soviética e do Estados Unidos durante a Guerra Fria . Os reatores norte-americanos em Hanford e Savannah River Site em South Carolina produziu 103 toneladas, e um número estimado de 170 toneladas de plutónio de qualidade militar foi produzido na URSS. Cada ano, cerca de 20 toneladas do elemento ainda é produzida como um subproduto da energia nuclear indústria. Até 1000 toneladas de plutónio pode ser armazenado com mais de 200 toneladas de que, dentro ou extraído de armas nucleares. SIPRI estimou o plutônio mundo arsenal em 2007 como cerca de 500 toneladas, divididas igualmente entre arma e estoques civis.

Desde o fim da Guerra Fria esses estoques tornaram-se um foco de preocupações proliferação nuclear. Em os EUA, alguns plutónio extraído de armas nucleares desmontadas é fundido para formar toros de vidro de óxido de plutónio que pesam duas toneladas. O vidro é feito de borossilicatos misturados com cádmio e gadolínio . Esses logs estão planejados para serem encerradas em aço inoxidável e armazenado até 4 km (2 mi) subterrânea em poços que serão back-cheias de concreto. a partir de 2008, a única instalação em que os EUA estava programado para armazenar plutônio neste era a maneira Montanha Yucca, que é cerca de 100 milhas (160 km) a nordeste de Las Vegas, Nevada . Local e estadual oposição a este plano atrasou os esforços para armazenar lixo nuclear em Yucca Mountain. Em março de 2010, o Departamento de Energia retirou o seu pedido de licença para o repositório de Yucca Mountain "com prejuízo" eo financiamento eliminado para o Escritório de Gestão de Resíduos Radioativos Civil, que tinha conseguido o site da Montanha Yucca por 25 anos, cancelar o programa.
Experiências médicas
Durante e após o final da Segunda Guerra Mundial, os cientistas que trabalham no Projeto Manhattan e outros projetos de pesquisa de armas nucleares realizados estudos sobre os efeitos de plutónio em animais de laboratório e seres humanos. Os estudos em animais descobriu que alguns miligramas de plutónio por quilograma de tecido é uma dose letal.
No caso dos seres humanos, este envolvido injectar soluções contendo (tipicamente) cinco microgramas de plutônio em pacientes do hospital pensado para ser uma doença terminal, ou a ter uma expectativa de menos de dez anos, quer devido à idade ou condição de doença crônica vida. Este valor foi reduzido para um micrograma em julho de 1945 após estudos com animais descobriram que a maneira de plutónio próprio distribuído nos ossos era mais perigoso do que o rádio .
Dezoito cobaias humanas foram injetados com plutónio sem consentimento informado. Os testes foram usadas para criar ferramentas de diagnóstico para determinar a absorção de plutónio no corpo, a fim de desenvolver normas de segurança para trabalhar com plutônio.
O episódio é agora considerado uma grave violação da ética médica e do juramento de Hipócrates. Comentaristas mais simpáticas notaram que, enquanto foi definitivamente uma brecha na confiança e ética ", os efeitos das injeções de plutónio não eram tão prejudicial para os indivíduos como as notícias cedo pintadas, nem eram tão inconsequente como muitos cientistas, então e agora , acredite. "
Aplicações
Explosivos

O isótopo de plutônio-239 é um componente chave físsil em armas nucleares , devido à sua facilidade de fissão e disponibilidade. Encerrando da bomba do poço de plutônio em uma adulteração (uma camada opcional de material denso) diminui a quantidade de plutônio necessário para atingir a massa crítica refletindo nêutrons escapam de volta para o núcleo de plutônio. Isto reduz a quantidade de plutónio necessário para alcançar criticalidade de 16 Kg a 10 Kg, o que é uma esfera com um diâmetro de cerca de 10 centímetros (4 polegadas). Essa massa crítica é de cerca de um terço do que para o urânio-235.
O " Fat Man "bombas de plutônio -tipo produzidos durante oProjeto Manhattan usado compressão explosivo de plutônio para obter densidades significativamente mais elevados do que o normal, combinados com uma fonte de nêutrons central para iniciar a reação e aumentar a eficiência. Assim, era necessário apenas 6,2 kg de plutônio para umexplosivo rendimento equivalente a 20 quilotons de TNT. (Veja também design de arma nuclear.) Hipoteticamente, tão pouco quanto 4 kg de plutônio e talvez até menos poderia ser usado para fazer uma única bomba atômica usando projetos de montagens muito sofisticados.
Combustível de óxido misto
O combustível nuclear irradiado a partir normais reatores de água leve contém plutônio, mas é uma mistura de plutónio-242, 240, 239 e 238. A mistura não está suficientemente enriquecido para armas nucleares eficientes, mas pode ser usado uma vez como combustível MOX. Acidental causas da captura de neutrões a quantidade de plutónio-242 e 240 a crescer cada vez que o plutónio é irradiada num reactor com baixa velocidade neutrões "térmico", de modo que após o segundo ciclo, o plutónio só pode ser consumida por reactores de neutrões rápidos. Se reatores de nêutrons rápidos não estão disponíveis (o caso normal), o excesso de plutónio é geralmente descartado, e constitui a componente mais longa duração dos resíduos nucleares. O desejo de consumir esse plutónio e outros combustíveis transurânicos e reduzir a toxicidade dos resíduos é a razão usual engenheiros nucleares dar para fazer reatores de nêutrons rápidos.
O processo químico mais comum, PUREX ( P lutonium- UR anium EX tração) reprocessa combustível nuclear para extrair plutônio e urânio que pode ser usado para formar um óxido misto " de combustível MOX "para reutilização em reatores nucleares. Plutónio de grau podem ser adicionados à mistura de combustível. Combustível MOX é usado em reatores de água leve e é composto por 60 kg de plutônio por tonelada de combustível; depois de quatro anos, três quartos do plutônio é queimado (transformado em outros elementos). reatores são especificamente projetados para criar o material físsil mais do que consomem.
Combustível MOX tem sido usado desde os anos 1980 e é amplamente utilizado na Europa. Em setembro de 2000, os Estados Unidos ea Federação Russa assinaram um Contrato de Gestão de plutónio e Disposição pelo qual cada concordou em alienar 34 toneladas de plutónio de qualidade militar. O Departamento de Energia dos EUA planeja se desfazer de 34 toneladas de plutónio de qualidade militar nos Estados Unidos antes do final de 2019 por conversão do plutónio para um combustível MOX para ser utilizado em reactores nucleares comerciais.
Combustível MOX melhora burnup total. Uma barra de combustível é reprocessada depois de três anos de utilização para remover os resíduos, que então representam 3% do peso total das varas. Quaisquer isótopos de urânio ou plutónio produzidos durante esses três anos estão a haste esquerda e segue em produção. A presença de até 1% de gálio por massa em série arma liga de plutónio tem o potencial de interferir com o funcionamento a longo prazo de um reactor de água leve.
Plutónio recuperado de combustível de reator usado representa uma menos significativa perigo de proliferação, por causa da contaminação excessiva com não-físsil plutônio-240 e plutônio-242. A separação dos isótopos não é viável. Um reactor dedicado que opera em muito baixo burnup (daí a exposição mínima dos recém-formado de Pu-239 a neutrões adicionais que faz com que ele a ser transformado em isótopos mais pesados de plutónio) é geralmente necessário para produzir um material adequado para utilização em eficientes armas nucleares . Enquanto plutónio "armas-grade 'é definido para conter pelo menos 92% de plutônio-239 (do plutônio total), os Estados Unidos conseguiram detonar um dispositivo de sub-20kt usando plutônio acreditado para conter apenas cerca de 85% de plutônio-239, chamado plutônio 'grau combustível'. O plutônio 'reactores' produzido por um ciclo regular burnup LWR normalmente contém menos de 60% Pu-239, com até 30% parasitária Pu-240 / Pu-242, e 10-15% físsil Pu-241. É desconhecido se um dispositivo usando plutônio obtido a partir de resíduos nuclear civil reprocessado pode ser detonada, porém tal dispositivo poderia, hipoteticamente, chiadeira e espalhar material radioativo em uma grande área urbana. O AIEA conservadora classifica plutônio de todos os vetores isotópicas como material de "uso direto", isto é, "o material nuclear que pode ser utilizada para o fabrico de componentes de explosivos nucleares transmutação ou sem enriquecimento adicional".
241Amfoi recentemente sugerido para utilização como um agente desnaturante em hastes de plutónio de combustível do reactor para limitar ainda mais o seu potencial de proliferação.
Precauções
Toxicidade
Isótopos e compostos de plutónio são radioativos e se acumulam em medula óssea. Contaminação por óxido de plutónio foi o resultado de catástrofes nucleares e radioativos incidentes, incluindo acidentes nucleares militares em que armas nucleares foram queimadas. Estudos sobre os efeitos destes lançamentos menores, bem como da doença de envenenamento por radiação generalizada e morte após os bombardeios atômicos de Hiroshima e Nagasaki, forneceram informações consideráveis sobre os perigos, os sintomas eo prognóstico de envenenamento por radiação, que no caso do Japonês Hibakusha / sobreviventes foi em grande parte não relacionada com a exposição direta de plutônio.
Durante o decaimento do plutónio, três tipos de radiação são liberadas-alfa, beta e gama. A radiação alfa pode viajar a uma curta distância e não pode viajar através do exterior, camada morta da pele humana. Radiação beta pode penetrar na pele humana, mas não pode ir todo o caminho através do corpo. A radiação gama pode percorrer todo o caminho através do corpo. Alfa, beta e radiação gama são todas as formas de radiação ionizante. qualquer exposição aguda ou de longo prazo traz o perigo de graves resultados de saúde, incluindo doenças provocadas pela radiação, danos genéticos, câncer e morte. O perigo aumenta com a quantidade de exposição.
Mesmo que a radiação alfa não pode penetrar na pele, ingerido ou inalado plutónio faz irradiar órgãos internos. O esqueleto, onde plutónio é absorvido, e o fígado, onde se recolhe e se torna concentrada, estão em risco. O plutónio não é absorvido para dentro do corpo de forma eficiente quando ingerido; apenas 0,04% de óxido de plutónio é absorvida após a ingestão. O plutónio absorvido pelo organismo é excretada muito lentamente, com uma meia-vida biológica de 200 anos. Plutônio passa lentamente através das membranas celulares e fronteiras intestinais, então a absorção por ingestão e incorporação estrutura óssea prossegue muito lentamente.
O plutónio é mais perigoso quando inalado do que quando ingerido. O risco de câncer de pulmão aumenta uma vez que o total de radiação equivalente dose de plutónio inalado exceder 400 mSv. O Departamento de Energia dos EUA estima que o risco de câncer de vida de inalar partículas de plutônio 5000, cada um com cerca de 3 microns de largura, para ser 1% sobre a média dos EUA fundo. Ingestão ou inalação de grandes quantidades pode causar aguda envenenamento por radiação e da morte; nenhum ser humano é conhecido por ter morrido por causa da inalação ou ingestão de plutônio, e muitas pessoas têm quantidades mensuráveis de plutônio em seus corpos. O perigo de inalação é de cerca de 23.000 vezes maior do que a de urânio de qualidade, o perigo de ingestão cerca de 130.000 vezes maior.
O " teoria das partículas quentes "no qual uma partícula de poeira de plutônio irradia uma mancha localizada de tecido pulmonar tem sido testado e falso-essas partículas são mais móveis do que se pensava e toxicidade não é mensurável aumentado devido à forma de partículas.
Quando inalado, o plutônio pode passar para a corrente sanguínea. Uma vez na corrente sanguínea, movimentos de plutónio em todo o corpo e para os ossos, fígado ou outros órgãos do corpo. O plutónio que atinge os órgãos do corpo, geralmente permanece no corpo durante décadas e continua para expor o tecido circundante e, assim, a radiação pode causar cancro.
Uma citação comumente citado por Ralph Nader, afirma que uma libra de pó de plutônio se espalhar na atmosfera seria suficiente para matar 8 mil milhões de pessoas. No entanto, os cálculos mostram que uma libra de plutónio poderia matar não mais de 2 milhões de pessoas por inalação. Isso faz com que a toxicidade de plutónio com que mais ou menos equivalente de gás de nervos.
Várias populações de pessoas que tenham sido expostos ao plutónio poeira (por exemplo, pessoas que vivem abaixo-vento de locais de teste de Nevada, sobreviventes de Nagasaki, trabalhadores de instalações nucleares, e pacientes "terminais" injectados com Pu em 1945-1946 para estudar o metabolismo Pu) têm sido seguidas cuidadosamente e analisado. Estes estudos geralmente não mostram toxicidade especialmente alta plutónio ou resultados de câncer induzido por plutónio, como Albert Stevens que sobreviveram até uma idade avançada depois de ser injetado com plutônio. "Havia cerca de 25 trabalhadores de Los Alamos National Laboratory que inalaram uma quantidade considerável de pó de plutônio, durante 1940, de acordo com a teoria hot-partícula, cada um deles tem uma chance de 99,5% de ser morto por câncer de pulmão por agora, mas não tem Não houve um único câncer de pulmão entre eles. "
Plutónio tem um gosto metálico.
Potencial criticidade

Problemas de toxicidade de lado, deve-se tomar cuidado para evitar a acumulação de quantidades de plutônio que abordam a massa crítica, particularmente porque a massa crítica de plutónio é apenas um terço do que de urânio-235. Uma massa crítica de plutónio emite quantidades letais de neutrões e raios gama. de plutónio em solução é mais provável a formação de uma massa crítica do que a forma sólida, devido à moderação pelo hidrogénio em água.
Acidentes de criticalidade ter ocorrido no passado, alguns deles com consequências letais. O manuseio descuidado de tijolos de carboneto de tungstênio em torno de uma esfera de plutónio 6,2 kg resultou em uma dose fatal de radiação em Los Alamos, em 21 de agosto de 1945, quando o cientista Harry K. Daghlian, Jr. recebeu uma dose estimada em 5,1 Sievert (510 rems) e morreu 25 dias depois. Nove meses mais tarde, um outro cientista de Los Alamos, Louis Slotin, morreu de um acidente similar envolvendo um reflector de berílio e o mesmo núcleo plutónio (o chamado " núcleo demon ") que tinha previamente reivindicado a vida de Daghlian. Estes incidentes foram ficcionada no filme de 1989 Fat Man e Little Boy .
Em Dezembro de 1958, durante um processo de purificação de plutónio em Los Alamos, uma massa crítica foi formada num recipiente de mistura, o que resultou na morte de um operador química chamadaCecil Kelley. Outro acidentes nucleares ter ocorrido naUnião Soviética,Japão, aEstados Unidose muitos outros países.
Inflamabilidade
Plutónio metálico é um perigo de incêndio, especialmente se o material finamente dividido. Em um ambiente húmido, plutónio forma hidretos na sua superfície, que são pirofóricos e se podem inflamar em ar à temperatura ambiente. Plutónio se expande até 70% em volume como se oxida e, assim, pode quebrar seu recipiente. A radioactividade do material de queima é um risco adicional. O óxido de magnésio areia é provavelmente o material mais eficaz para extinguir um incêndio plutónio. Ele resfria o material de combustão, agindo como um dissipador de calor, e também bloqueia o oxigênio. Precauções especiais são necessárias para armazenar ou manipular Plutónio sob qualquer forma; geralmente uma seco atmosfera de gás inerte é necessária.
Transporte
Ar
Os regulamentos de transporte aéreo do governo dos EUA permitir o transporte de plutónio por via aérea, sujeitos a restrições de outras matérias perigosas transportadas no mesmo voo, requisitos de embalagem, e estiva na parte terminal da aeronave.
Em 2012 mídia revelou que o plutónio foi levado para fora da Noruega sobre comerciais companhias aéreas-em torno de passageiros todos os outros uma vez em 2011. regulamentos permitem que um avião para o transporte de 15 gramas de material físsil-incluindo o ano. Tal transporte de plutónio é sem problemas, de acordo com um conselheiro sênior ( seniorrådgiver ) no Statens strålevern.
![\ Mathrm {^ {238} _ {\ 92} L \ + \ ^ _ {1} {0} n \ \ longrightarrow \ ^ {239} _ {\ 92} L \ \ xrightarrow [23.5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94}} Pu](../../images/2301/230147.png)
![\ Mathrm {^ {238} _ {\ 92} L \ + \ ^ {2} _ {1} D \ \ longrightarrow \ ^ {238} _ {\ 93} Np \ + \ 2 \ ^ {1} _ { 0} n \ quad; \ quad ^ {238} _ {\ 93} Np \ \ xrightarrow [2.117 \ d] {\ beta ^ -} \ ^ {238} _ {\ 94}} Pu](../../images/2301/230148.png)
