
Ponto de ebulição
Informações de fundo
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Crianças SOS tem cuidado de crianças na África por 40 anos. Você pode ajudar o seu trabalho na África ?
O ponto de ebulição de um líquido é a temperatura à qual o a pressão de vapor do líquido é igual à pressão do meio ambiente circundante do líquido. Um líquido num ambiente de vácuo tem um ponto de ebulição mais baixo do que quando o líquido se encontra pressão atmosférica. E um líquido num ambiente de alta pressão tem um ponto de ebulição mais elevado do que quando o líquido está à pressão atmosférica. Por outras palavras, todos os líquidos ter um número infinito de pontos de ebulição.
O ponto de ebulição normal (também chamado de ponto de ebulição atmosférico ou o ponto de ebulição à pressão atmosférica) de um líquido é o caso especial em que a pressão de vapor do líquido é igual à pressão atmosférica ao nível do mar definido, de 1 atmosfera. A essa temperatura, a pressão de vapor do líquido torna-se suficiente para superar a pressão atmosférica e levantar o líquido para formar bolhas no interior da massa do líquido. O ponto de ebulição é agora padrão (como de 1982) definido pela IUPAC como a temperatura à qual ebulição ocorre sob uma pressão de 1 bar.
O calor de vaporização é a quantidade de calor necessária para converter ou vaporizar um líquido saturado (isto é, um líquido no seu ponto de ebulição) em vapor.
Os líquidos podem mudar para um vapor a temperaturas abaixo dos seus pontos de ebulição com o processo de evaporação. A evaporação é um fenómeno em que as moléculas de superfície localizada perto da superfície de fuga de vapor / líquido para a fase de vapor. Por outro lado, é um processo em ebulição, em que as moléculas em qualquer parte do líquido de fuga, o que resulta na formação de bolhas de vapor no interior do líquido.
A temperatura e pressão de saturação
Um líquido saturado contém tanta energia térmica, pois ele pode, sem ferver (ou, inversamente, um vapor saturado contém o mínimo de energia térmica, uma vez que pode, sem condensação).
Temperatura de saturação significa ponto de ebulição. A temperatura de saturação é a temperatura para uma pressão de saturação correspondente à qual um líquido ferve em seu vapor fase . O líquido pode ser dito para ser saturado com energia térmica. Qualquer adição de resultados de energia térmica em uma mudança de fase.
Se o pressão num sistema permanece constante ( isobárica), um vapor à temperatura de saturação começarão a condensar-se em fase líquida como energia térmica ( calor ) é removido. Da mesma forma, um líquido à temperatura e pressão de saturação irá ferver na sua fase de vapor como é aplicada energia térmica adicional.
O ponto de ebulição corresponde à temperatura à qual a pressão de vapor do líquido é igual à pressão do meio ambiente circundante. Assim, o ponto de ebulição é dependente da pressão. Geralmente, os pontos de ebulição são publicados em relação à pressão atmosférica (101,325 ou um quilopascal atm). Em altitudes mais elevadas, onde a pressão atmosférica é muito menor, o ponto de ebulição é também inferior. O ponto de ebulição aumenta com o aumento da pressão até o ponto crítico, onde as propriedades de gases e líquidos tornam-se idênticas. O ponto de ebulição não pode ser aumentada para além do ponto crítico. Da mesma forma, o ponto de ebulição decresce com a diminuição da pressão até que o ponto triplo é atingido. O ponto de ebulição não pode ser reduzido abaixo do ponto triplo.
Se o calor de vaporização e a pressão de vapor de um líquido a uma determinada temperatura é conhecido, o ponto de ebulição normal pode ser calculado utilizando-se a Equação de Clausius-Clapeyron assim:
![T_B = \ Bigg (\ frac {\, R \, [\, \ ln (P_0) - \ ln (101,325) \,]} {\ Delta H_ {vap}} + \ frac {1} {t_0} \ Bigg ) ^ {- 1}](../../images/154/15428.png)
| onde: | |
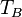 | = Ponto de ebulição normal, K |
|---|---|
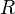 | = A constante dos gases perfeitos, 8,314 J · K -1 · mol -1 |
 | = É a pressão de vapor a uma dada temperatura, kPa |
 | = Pressão atmosférica, kPa |
 | = Calor de vaporização do líquido, J / mol |
 | = A temperatura dada, K |
 | = O logaritmo natural à base e |
Pressão de saturação é a pressão para uma temperatura de saturação correspondente à qual um líquido ferve na sua fase de vapor. Pressão de saturação e temperatura de saturação tem uma relação direta: quanto pressão de saturação aumenta, por isso é a temperatura de saturação.
Se a temperatura numa sistema permanece constante (um sistema isotérmico), a pressão de vapor de saturação e temperatura começará a condensar na sua fase líquida como a pressão do sistema é aumentada. Da mesma forma, um líquido a uma pressão e temperatura de saturação tenderá a piscar na sua fase de vapor, como a pressão do sistema é reduzida.
O ponto de ebulição da água é de 100 ° C (212 ° F) à pressão normal. No topo do Monte Everest , a pressão é cerca de 260 mbar (26,39 kPa), de modo que o ponto de ebulição da água é de 69 ° C . (156,2 ° F).
Para puristas, o ponto de ebulição normal de água é 99,97 graus Celsius, a uma pressão de 1 atm (ou seja, 101,325 kPa). Até 1982 este foi também o ponto de ebulição normal da água, mas o IUPAC recomenda agora uma pressão normal de 1 bar (100 kPa). A esta pressão ligeiramente reduzida, o ponto de ebulição normal de água é 99,61 graus Celsius.
Relação entre o ponto de ebulição normal e a pressão de vapor de líquidos

Quanto maior for a pressão de vapor de um líquido a uma determinada temperatura, menor é o ponto de ebulição normal (ou seja, o ponto de ebulição à pressão atmosférica) do líquido.
O gráfico de pressão de vapor para a direita tem gráficos das pressões de vapor versus temperatura para uma variedade de líquidos. Como pode ser visto no gráfico, os líquidos com as pressões mais altas de vapor tem os baixos pontos de ebulição normais.
Por exemplo, a qualquer dada temperatura, o propano tem a mais alta pressão de vapor de qualquer um dos líquidos no gráfico. Ele também tem o mais baixo ponto de ebulição normal (-43,7 ° C), que é onde a curva de pressão de vapor de propano (a linha púrpura) intersecta a linha horizontal de pressão de uma atmosfera ( atm) de pressão de vapor absoluta.
Em termos de interacções intermoleculares, o ponto de ebulição representa o ponto no qual o líquido moléculas possuem suficiente energia térmica para superar as várias atrações intermoleculares de ligação das moléculas no líquido (por exemplo. atração dipolo-dipolo, instantâneo-dipolo induzido-dipolo atrações, e pontes de hidrogênio). Por conseguinte, o ponto de ebulição é também um indicador da resistência dessas forças atractivas.
Propriedades de outros elementos
O elemento de ponto de ebulição mais baixo é o hélio . Ambos os pontos de ebulição de rênio e tungstênio exceder 5000 K em pressão normal. Devido à dificuldade de medir com precisão experimental temperaturas extremas sem polarização, existe alguma discrepância na literatura quanto ao facto de tungsténio ou rénio tem o ponto de ebulição mais elevado.
