
Erbium
Você sabia ...
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Patrocinar crianças ajuda crianças no mundo em desenvolvimento para aprender também.
| Erbium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
68 Er | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
branco prateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | érbio, Er, 68 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / ɜr b Eu ə m / UR -bee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | lantanídeos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 167,259 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 4f 12 2 2, 8, 18, 30, 8, 2 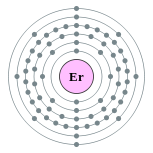 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Carl Gustaf Mosander (1842) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 9,066 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 8,86 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1802 K , 1529 ° C, 2784 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3141 K, 2868 ° C, 5194 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 19.90 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 280 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 28,12 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 3, 2, 1 ( óxido de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,24 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 589,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1150 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2194 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 176 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 189 ± 18:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético a 300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) (poli) 0,860 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 14,5 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | ( RT) (poli) 12,2 mM / (mK) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2830 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 69,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 28,3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 44,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,237 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 589 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 814 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-52-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de érbio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Érbio é um elemento químico no lantanídeos série, com o símbolo Er e número atômico 68. Um metal sólido branco prateado quando artificialmente isolados, érbio natural é sempre encontrado em combinação química com outros elementos da Terra. Como tal, é um terra-rara, que está associada com vários outros elementos raros na mineral gadolinite de Ytterby na Suécia .
Principais aplicações do érbio envolver seus íons Er 3+ rosa de cor, que têm propriedades fluorescentes ópticos particularmente úteis em certas aplicações de laser. Vidros dopados com érbio ou cristais pode ser utilizado como meio de amplificação óptico, em que os iões de érbio (III) são bombeados opticamente em cerca de 980 nm ou 1480 nm e, em seguida, irradiam luz em 1530 nm de emissão estimulada. Este processo resulta em um invulgarmente mecanicamente simples de laser amplificador óptico para sinais transmitidos pela fibra óptica. O nm de comprimento de onda 1550 é especialmente importante para comunicações ópticas porque o modo padrão único de fibras ópticas têm perda mínima neste comprimento de onda particular. Além de lasers de fibra óptica, uma grande variedade de aplicações médicas (ou seja, dermatologia, odontologia) utilizam 2940 nm de emissão do íon de érbio (veja Er: YAG), que é altamente absorvido em tecidos em água, tornando o seu efeito muito superficial. Tal deposição de tecido superficial da energia do laser é útil na cirurgia a laser, e para a produção eficiente de vapor para a ablação a laser esmalte em certos tipos de odontologia a laser.
Características
Propriedades físicas

A trivalente elemento, érbio puro de metal é maleável (ou facilmente em forma), soft ainda estável no ar, e não faz oxidar mais rapidamente alguma outra metais de terras raras. Sua sais são cor de rosa, eo elemento tem a característica acentuada bandas de espectro de absorção de luz visível , ultravioleta , e perto infravermelho. Caso contrário, ele se parece muito com as outras terras raras. Sua sesquióxido é chamada érbia. Propriedades de érbio é de um grau ditada pelo tipo e quantidade de impurezas presentes. O érbio não desempenham qualquer papel biológico conhecido, mas pensa-se ser capaz de estimular metabolismo.
Erbium é ferromagnético abaixo de 19 K, antiferromagnetic entre 19 e 80 K e paramagnético acima de 80 K.
Érbio podem formar em forma de hélice agrupamentos atómicos Er 3 N, em que a distância entre os átomos de érbio é de 0,35 nm. Esses agrupamentos podem ser isolados por encapsulando-os em moléculas de fulereno, como confirmado por microscopia eletrônica de transmissão.
Propriedades químicas
Erbium de metal mancha lentamente no ar e queimaduras prontamente para formar érbio (III), óxido de:
- 4 ER + 3 O 2 → 2 Er 2 O 3
Erbium é bastante electropositive e reage lentamente com água fria e muito rapidamente com água quente para formar hidróxido de érbio:
- Er 2 (s) + 6 H2O (l) → Er 2 (OH) 3 (aq) + 3H 2 (g)
Érbio de metal reage com todos os halogéneos:
- Er 2 (s) + 3 F 2 (g) → ERF 2 3 (s) [rosa]
- Er 2 (s) + 3 Cl2 (g) → 2 ErCl 3 (s) [violeta]
- Er 2 (s) + 3 Br 2 (g) → 2 ErBr 3 (s) [violeta]
- Er 2 (s) + 3 I 2 (g) → 2 eri 3 (s) [violeta]
Érbio dissolve prontamente em diluída de ácido sulfúrico para formar soluções contendo (iii) iões hidratados Er, que existem como amarelo [Er (OH 2) 9] 3+ complexos de hidratação:
- Er 2 (s) + 3 H 2 SO 4 (aq) → 2 Er 3+ (aq) + SO 3 2-
4 (aq) + 3H 2 (g)
Isótopos
Naturalmente que ocorre erbium é composta por 6 estáveis isótopos , 162 Er, Er 164, 166 Er, Er 167, 168 Er, e 170 Er com 166 Er sendo o mais abundante (33,503% abundância natural). 29 radioisótopos foram identificados, sendo os mais estáveis 169 Er com uma meia-vida de 9,4 d, 172 Er, com uma meia-vida de 49,3 h, 160 Er, com uma semi-vida de 28,58 horas, 165 Er, com uma meia-vida de 10,36 h, e Er 171 com uma meia-vida de 7,516 h. Todos os restantes Os isótopos radioactivos têm semi-vidas que são menos do que 3,5 h, e a maioria delas têm semi-vidas que são menos do que 4 minutos. Este elemento também tem 13 meta estados, sendo o Er ser 167m mais estável com uma meia-vida de 2,269 s.
Os isótopos de érbio na gama peso atômico de 142.9663 u (Er 143) para 176,9541 u (Er 177). O primário modo de decaimento antes do isótopo estável mais abundante, 166 Er, é captura eletrônica, eo primeiro modo após é decaimento beta. O primário produtos de decaimento antes do 166 Er são elementos (67 hólmio ) isótopos, e os produtos primários após são elemento 69 ( Túlio ) isótopos.
História
Erbium (para Ytterby, uma aldeia na Suécia ) foi descoberto por Carl Gustaf Mosander em 1843. Mosander separados "yttria" do mineral gadolinite em três frações que chamou ítria, érbia, e térbia. Ele nomeou o novo elemento após a vila de Ytterby, onde grandes concentrações de óxido de ítrio e érbio estão localizados. Érbia e térbia, no entanto, ficaram confusos no momento. Depois de 1860, foi rebatizado térbia érbia e depois de 1877 que havia sido conhecido como érbia foi rebatizado térbia. Bastante puro Er 2 O 3 foi isolado independentemente em 1905 por Georges Urbain e Charles James. Razoavelmente metal puro não foi produzido até 1934 quando Klemm e Bommer reduziram o anidro com cloreto de potássio de vapor. Foi somente na década de 1990 que o preço do óxido de érbio Chinês-derivadas tornou-se suficientemente baixa para érbio a ser considerado para uso como corante em arte em vidro.
Ocorrência

A concentração de érbio na crosta da Terra é de cerca de 2,8 mg / kg e na água do mar de 0,9 ng / L. Esta concentração é suficiente para fazer cerca de 45 erbium em abundância elementar na crosta da Terra.
Como outras terras raras, este elemento nunca é encontrado como elemento livre na natureza, mas é encontrado amarrado em minérios de areia monazita. Historicamente, tem sido muito difícil e dispendioso separar terras raras entre si nos seus minérios mas técnicas de produção de troca iônica desenvolvidas no final do século 20 muito têm trazido para baixo o custo de produção de todos os metais de terras raras e seus compostos químicos .
As principais fontes comerciais de érbio são a partir dos minerais xenotime e euxenite e, mais recentemente, as argilas de adsorção de íons do sul da China; em consequência, a China tornou-se o principal fornecedor global deste elemento. Nas versões de alta ítrio destes concentrados de minérios, ítrio é de cerca de dois terços do total, em peso, e érbia é de cerca de 4-5%. Quando o concentrado é dissolvido em ácido, o érbia liberta iões de érbio suficiente para dar uma cor-de-rosa e característica distinta para a solução. Este comportamento cor é semelhante ao que Mosander e os outros trabalhadores precoces nas lantanídeos teria visto em seus extratos a partir dos minerais gadolinita de Ytterby.
Produção
Minerais esmagadas são atacados por clorídrico ou ácido sulfúrico , que transforma insolúveis óxidos de terras raras solúveis em cloretos ou sulfatos. Os filtrados ácidos são parcialmente neutralizados com soda cáustica (hidróxido de sódio) a pH 3-4. Tório precipita da solução como hidróxido e é removido. Depois que a solução é tratada com oxalato de amónio para converter terras raras em sua insolúvel oxalatos. Os oxalatos são convertidos em óxidos por recozimento. Os óxidos são dissolvidos em ácido nítrico que exclui um dos principais componentes, de cério , cujas óxido é insolúvel em HNO 3. A solução é tratada com nitrato de magnésio para produzir uma mistura de cristalizou sais duplos de metais de terras raras. Os sais são separados por de permuta iónica. Neste processo, os iões de terras raras está sorvido sobre resina de permuta iónica adequada por permuta com hidrogénio, de amónio ou iões cúpricos presentes na resina. Os íons de terras raras são então lavados seletivamente pelo agente de complexação adequado. Érbio metal é obtido a partir do seu óxido ou sais por aquecimento com cálcio a 1450 ° C sob atmosfera de árgon.
Aplicações

Usos diários do érbio são variados. É normalmente usado como um filtro fotográfico, e devido à sua resiliência, é útil como um aditivo metalúrgica. Outros usos:
- Usado em nuclear em tecnologia de absorção de nêutrons hastes de controle.
- Quando adicionado ao vanádio como um liga, érbio baixa dureza e melhora a trabalhabilidade.
- Óxido de érbio tem uma cor rosa, e às vezes é usado como um corante para vidro , zircônia cúbica e de porcelana. O vidro é, então, usado frequentemente no óculos de sol e barato jóias .
- Dopado com érbio fibras de sílica de vidro óptico são o elemento ativo em amplificadores de fibra dopada com érbio (EDFAs), os quais são amplamente usados em comunicações ópticas. As mesmas fibras pode ser utilizado para criar fibras lasers . Co-doping de fibra óptica com Er e Yb é usado em de alta potência Er / lasers de fibra Yb, que gradualmente substituam CO 2 lasers para soldadura de metal e aplicações de corte. Érbio também pode ser utilizado em amplificadores de guia de onda dopado com érbio.
- Um erbium- níquel liga de Ni Er 3 tem uma capacidade de calor específica invulgarmente elevada a temperaturas do hélio líquido e é utilizada em cryocoolers; uma mistura de 65% Er 3 Co e 35% Er 0,9 Yb 0,1 Ni em volume melhora a capacidade de calor específico ainda mais.
- Uma grande variedade de aplicações médicas (ou seja, dermatologia, odontologia) utilizam 2940 nm de emissão de iões de érbio (veja Er: YAG), que é altamente absorvida em água ( coeficiente de absorção cerca de 12 mil / cm). Tal deposição superficial de tecido a energia do laser é necessário para a cirurgia a laser, e a produção eficiente de vapor para a ablação a laser esmalte em odontologia.
Papel biológico
Não Erbium não tem um papel biológico, mas sais de érbio pode estimular metabolismo. Os seres humanos consomem 1 miligrama de érbio por ano em média. A maior concentração de érbio é os seres humanos é a da ossos, mas também há érbio nos humanos rins e fígado.
Toxicidade
Erbium é levemente tóxico se ingerido, mas compostos de érbio não são tóxicos. Érbio metálico em forma de pó apresenta um risco de incêndio e explosão.
Cultura popular
No romance de Carl Sagan "Contato", uma máquina é construída a partir de um modelo recebida através de uma transmissão de rádio extraterrestre. Um componente importante (e inexplicável) da máquina são construídos a partir de tarugos de érbio.
