
Bário
Fundo para as escolas Wikipédia
Crianças SOS têm produzido uma seleção de artigos da Wikipedia para escolas desde 2005. Crianças SOS tem cuidado de crianças em África há 40 anos. Você pode ajudar o seu trabalho na África ?
| Bário | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
56 Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
cinza prateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | bário, Ba, 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / b ɛər Eu ə m / BAIR -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | metais alcalino-terrosos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | (2) de metais alcalino-terrosos , 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 137,327 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 2 2, 8, 18, 18, 8, 2 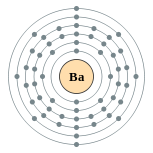 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Carl Wilhelm Scheele (1772) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 3,51 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 3,338 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1000 K , 727 ° C, 1341 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 2170 K, 1897 ° C, 3447 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 7.12 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 140,3 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 28,07 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2 (Fortemente óxido de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 0,89 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 502,9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ª: 965,2 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3600 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 222 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 215 ± 11 horas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 268 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 332 Nco · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 18,4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 20,6 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 1.620 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 4.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 9,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 1,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de bário | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
O bário é um elemento químico com o símbolo de Ba e número atômico 56. É o quinto elemento do Grupo 2, um prateado macio metálico alcalino-terroso . Devido à sua alta estabilidade química reatividade bário nunca é encontrado na natureza como elemento livre. Sua hidróxido era conhecido na história pré-moderna como baryta; esta substância não ocorre como um mineral, mas podem ser preparados por aquecimento de carbonato de bário.
Os minerais de ocorrência mais comum, naturalmente, de bário são barita (sulfato de bário, BaSO4) e witherite (carbonato de bário, BaCO 3), ambos sendo insolúvel em água. O nome de bário origina do derivado alquímica "baryta", que se vem do grego βαρύς (barys), que significa "pesado". Bário foi identificado como um novo elemento em 1774, mas não reduzida a um metal de até 1808, pouco depois de técnicas de isolamento electrolíticos se tornou disponível.
Bário tem apenas algumas aplicações industriais. O metal tem sido historicamente usado para limpar o ar em tubos a vácuo. É um componente de YBCO ( supercondutores de alta temperatura) e cerâmica eléctrica, e é adicionado ao aço e ferro fundido para reduzir o tamanho de grãos de carbono dentro da microestrutura do metal. Compostos de bário são adicionados aos fogos de artifício para dar uma cor verde. O sulfato de bário é usado como um aditivo para pesado insolúvel poço de petróleo fluido de perfuração, e na forma pura, como raios-X agentes de radiocontraste para geração de imagens do trato gastrointestinal humano. Compostos de bário solúvel são tóxicos, devido à libertação do ião de bário solúvel e, portanto, foram utilizados como rodenticidas.
Características
Propriedades físicas

O bário é um metal macio, prateado-branco, com um leve tom dourado quando ultrapura. A cor branco-prateado de metal de bário desaparece rapidamente após oxidação ao ar obtendo-se uma camada de óxido de cinzento escuro. Bário tem um meio peso específico e boa condutividade elétrica. Ultrapure bário é muito difícil de preparar, e, portanto, muitas propriedades de bário não foram medidas com precisão ainda.
À temperatura ambiente e à pressão, tem uma bário corpo centrado estrutura cúbica, com uma distância de bário-bário de 503 picometros, em expansão, com aquecimento a uma taxa de aproximadamente 1,8 x 10 -5 / ° C. É um metal muito macio com uma dureza de Mohs de 1,25. A sua temperatura de fusão de 1000 K (730 ° C; 1340 ° F) é intermédio entre os do estrôncio isqueiro (1050 K, 780 ° C; 1430 ° F) e mais pesado rádio (973 K, 700 ° C; 1.292 ° F) ; no entanto, o seu ponto de 2170 K (1900 ° C; 3.450 ° F) excede a ebulição de estrôncio (1655 K, 1382 ° C; 2.519 ° F). A densidade (3,62 g · cm -3) é novamente intermediárias entre aquelas de estrôncio (2,36 g · cm -3) e rádio (~ 5 g · cm -3).
Reatividade química
O bário é quimicamente semelhante à de magnésio, cálcio, e estrôncio, sendo ainda mais reactiva. É sempre apresenta o estado de oxidação de +2. Reações com Calcogênios são altamente exotérmica (energia release); a reacção com o oxigénio ou ar ocorre à temperatura ambiente, e, portanto, de bário é armazenado sob atmosfera de petróleo ou de gás inerte. Reações com outro não-metais, tais como carbono, azoto, fósforo, silício e hidrogénio, são geralmente exotérmica e prosseguir após aquecimento. Reações com água e álcoois são também muito exotérmica e liberar gás hidrogênio:
- Ba + 2 ROH → Ba (OR) 2 + H 2 ↑ (R é um grupo alquilo ou um átomo de hidrogénio)
Além disso, bário reage com amónia para formar complexos, tais como Ba (NH3) 6.
O metal é prontamente atacado pela maioria dos ácidos. O ácido sulfúrico é uma notável excepção, como passivação pára a reacção por formação do insolúvel sulfato de bário. Bário combina com vários metais, incluindo alumínio , zinco , chumbo e estanho , formando fases e ligas intermetálicas.
Compostos
| O 2- | S 2- | F - | Cl - | SO 2- 4 | CO 2 3 | O 2- 2 | H - | |
|---|---|---|---|---|---|---|---|---|
| Ca 2+ | 3.34 | 2.59 | 3.18 | 2.15 | 2.96 | 2.83 | 2,9 | 1,7 |
| Sr 2+ | 5.1 | 3.7 | 4.24 | 3.05 | 3.96 | 3,5 | 4,78 | 3.26 |
| Ba 2+ | 5,72 | 4.3 | 2.1 | 1.9 | 4.49 | 4.29 | 4.96 | 4.16 |
| Zn 2+ | 5.6 | 4.09 | 4.9 | 2.09 | 3.8 | 4.4 | 1.57 | - |
Sais de bário são tipicamente branco e quando sólido incolor quando dissolvido, como iões de bário fornecer nenhuma coloração específica. Eles são também mais denso do que os seus estrôncio ou cálcio análogos, excepto para o halogenetos (ver tabela; zinco é dada para efeitos de comparação).
Hidróxido de bário ("baryta") era conhecido por alquimistas que produziram aquecendo carbonato de bário. Ao contrário de hidróxido de cálcio, que absorve muito pouco CO 2 em soluções aquosas e, portanto, é insensível a variações atmosféricas. Esta propriedade é usada na calibração de equipamentos de pH.
Compostos de bário voláteis queimar com um verde para verde pálido chama, que é um teste eficiente para detectar um composto de bário. Os resultados de cores de linhas espectrais em 455,4, 493,4, 553,6, 611,1 e nm.
Compostos Organobarium são uma classe de compostos de crescimento: por exemplo, dialkylbariums são conhecidos, como são alkylhalobariums.
Isótopos
Bário ocorre naturalmente na Terra como uma mistura de sete nuclidos primordiais, bário-130, 132, 134 e 138. através Os dois primeiros são pensados para ser radioativo: bário-130 deve decair para xenônio-130 via dupla beta mais decadência, e bário-132 deve semelhante decair para xenônio-132. Os correspondentes meias-vidas devem exceder a idade do universo por pelo menos mil vezes. As abundâncias são ~ 0,1% em relação à de bário natural. Sua radioatividade é tão fraco que não representam perigo para a vida. Fora dos isótopos estáveis, bário-138 torna-se 71,7% de todo o bário, e o isqueiro do isótopo, a menos que é abundante. No total, bário tem cerca de 50 isótopos conhecidos, que variam em massa entre 114 e 153. O isótopo metastável é mais estável de bário-133, que tem uma meia-vida de cerca de 10,51 anos, e mais cinco isótopos têm a sua semi-vida mais longa do que um dia. Bário também tem 10 metaestáveis, dos quais bário-133m1 é a mais estável, tendo uma meia-vida de cerca de 39 horas.
História

Os alquimistas da Idade Média adiantada sabia sobre alguns minerais de bário. Pedras seixo-como lisas de bário mineral encontrado em Bolonha , Itália , eram conhecidos como "pedras de Bolonha". Bruxas e alquimistas foram atraídos para eles, porque após a exposição à luz iriam brilhar por anos. As propriedades fosforescentes de barita aquecida com produtos orgânicos foram descritos por V. Casciorolus em 1602.
Carl Scheele identificado barita como contendo um elemento novo em 1774, mas não conseguiu isolar bário, única óxido de bário. Johan Gottlieb Gahn também isolado óxido de bário dois anos mais tarde em estudos semelhantes. Bário oxidado foi primeiramente chamado "barote," por Guyton de Morveau, um nome que foi mudado por Antoine Lavoisier para barita. Além disso, no século 18, mineralogista Inglês William Withering observou um mineral pesado nas minas de chumbo de Cumberland, agora conhecidos como sendo witherite. Bário foi isolado pela primeira vez por electrólise de sais de bário fundido em 1808, por Sir Humphry Davy na Inglaterra . Davy, por analogia com cálcio chamado "bário" depois baryta, com o final "ónio" significando um elemento metálico. Robert Bunsen e Augustus Matthiessen obtido bário puro por eletrólise de uma mistura fundida de e cloreto de bário de cloreto de amónio.
A produção de oxigénio puro no Processo Brin era uma aplicação em larga escala de peróxido de bário na década de 1880, antes de ser substituído por eletrólise e destilação fracionada do ar liquefeito no início de 1900. Neste processo de bário óxido reage a 500-600 ° C (932-1112 ° F) com o ar para formar peróxido de bário, que se decompõe acima de 700 ° C (1292 ° F), libertando oxigénio:
- BaO 2 + O 2 ⇌ 2 BaO 2
Em 1908, o sulfato de bário foi aplicado como um primeiro agente de contraste radiológico em Imagiologia de raios-X do sistema digestivo.
Ocorrência e produção
A abundância de bário é 0,0425% na crosta da Terra e 13 ug / L na água do mar. A principal fonte comercial de bário é barita (também chamados barites ou espato pesado), que é um mineral de sulfato de bário. Seus depósitos estão espalhados por todo o mundo. A única outra fonte comercial é muito menos importante do que barita; é witherite, um mineral de carbonato de bário. Seus principais depósitos estão localizados na Inglaterra, Romênia e da ex-URSS.

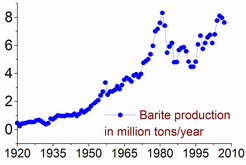
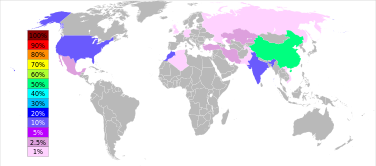
Os barita reservas são estimadas entre 0,7 e 2 bilhões toneladas. A produção máxima foi atingida em 1981, em 8,3 milhões de toneladas, e apenas 7-8% do que foi usado para fazer bário ou seus compostos. A produção barita foi novamente aumentado desde a segunda metade da década de 1990: a partir de 5,6 milhões de toneladas em 1996 para 7,6 em 2005 e 7,8 em 2011. A China é responsável por mais de 50% desta produção, seguida pela Índia (14% em 2011), Marrocos (8,3%), EUA (8,2%), Turquia (2,5%), Irã e Cazaquistão (2,6% cada).
O minério extraído é lavado, esmagado, classificados e separados a partir de quartzo. Se o quartzo penetra muito profundamente no minério, ou o ferro, zinco, ou o conteúdo de chumbo é anormalmente alta, então métodos de flotação são aplicadas. O produto puro é uma barita 98% (em massa); a pureza não deve ser inferior a 95%, com um teor mínimo de ferro e dióxido de silício . Em seguida, é reduzido pela presença de carbono em sulfureto de bário:
- Baso 4 + 2 → C BaS + 2 CO 2 ↑
O sulfureto de bário solúvel em água é o ponto de partida para outros compostos: BaS dissolvido após reacção com oxigénio dá o hidróxido, com ácido nítrico a nitratos, com dióxido de carbono a carbonato, e assim por diante. O nitrato pode ser decomposto termicamente para se obter o óxido. Bário de metal é produzido por redução com alumínio a 1.100 ° C (2.010 ° F). O Baal composto intermetálico 4 é produzido pela primeira vez:
- 3 BaO + 14 → Al 3 Baal 4 + Al 2 O 3
É um intermediário, o qual reage com o óxido de bário para dar o metal. Note-se que nem todos de bário é reduzida.
- 8 BaO + Baal 4 → Ba ↑ + 7 Baal 2 O 4
O óxido de bário restante reage com o óxido de alumínio formado:
- BaO + Al 2 O 3 → Baal 2 O 4
e a reacção global é
- 4 BaO + 2 Al → 3 Ba ↑ + Baal 2 O 4
O vapor de bário assim produzido é coletado na parte mais fria do aparelho e, em seguida, colocados em moldes sob atmosfera de árgon. Este método é usado comercialmente e pode produzir ultrapura bário. Bário comumente vendido é cerca de 99% puro, com impurezas principais sendo estrôncio e cálcio (até 0,8% e 0,25%) e outros contaminantes que contribui menos do que 0,1%.
Uma reacção semelhante com silício a 1200 ° C (2190 ° F) produz bário e bário metasilicate. A electrólise não é usado porque se dissolve prontamente em bário halogenetos de fundição e é bastante impuro quando isolado com este método.

Pedra preciosa
Um mineral contendo bário benitoite (silicato de bário titânio) ocorre como uma pedra preciosa azul fluorescente muito raro, e é a jóia oficial do estado de Califórnia .
Aplicações
Metais e ligas
Bário, como um metal ou, quando ligado com alumínio, é utilizado para remover gases indesejados ( gettering) a partir de tubos de vácuo, tais como tubos de imagem de TV. O bário é adequado para esta finalidade devido ao seu baixo pressão de vapor e reactividade face de oxigénio, azoto, dióxido de carbono e água; ele pode remover mesmo parcialmente gases nobres dissolvendo-os na estrutura de cristal. Esta aplicação está desaparecendo gradualmente, devido à crescente popularidade dos conjuntos de LCD e plasma tubeless.
Outros usos de bário elementar são menores e incluem um aditivo para silumina (ligas de alumínio-silício) que refina sua estrutura, bem como
- tendo ligas;
- chumbo-estanho ligas de solda - para aumentar a resistência à fluência;
- liga com níquel para velas de ignição;
- aditivo para o aço e ferro fundido como um inoculante;
- ligas com cálcio, manganês, silício e alumínio como desoxidantes aço de alta qualidade.
O sulfato de bário e barita

O sulfato de bário (barita, a, BaSO4) é importante para a indústria do petróleo, por exemplo, como um fluido de perfuração em poços de petróleo e gás. O precipitado do composto (chamado "blanc fixe", a partir de uma expressão francesa que significa "branco permanente") é usado em tintas e vernizes, e também como um agente de enchimento de tinta no toque, plásticos e borrachas. É também um pigmento de revestimento de papel. Sob a forma de nanopartículas, que podem melhorar as propriedades físicas de alguns polímeros, tal como epóxi.
O sulfato de bário tem uma toxicidade baixa e densidade relativamente alta de ca. 4,5 g · cm -3 (e, portanto, a opacidade aos raios-X). Por esta razão, é utilizado como um agente de contraste radiológico em Imagiologia de raios-X do sistema digestivo (" refeições bário "e" enemas de bário "). Litopone, um pigmento que contém sulfato de bário e sulfeto de zinco, é um branco permanente que tem um bom poder de cobertura e não escurece quando exposto aos sulfetos.
Outros compostos de bário

Além do sulfato, outros compostos de bário encontrar apenas aplicações de nicho. Os pedidos são limitados pela toxicidade dos iões Ba2 + (carbonato de bário é um veneno de rato), que não é um problema para o BaSO 4 insolúvel.
- Óxido de bário é utilizado no revestimento para a eléctrodos de lâmpadas fluorescentes, o que facilita a liberação de elétrons .
- Carbonato de bário é usado na indústria vidreira. Sendo um elemento pesado, bário aumenta a índice de refracção e brilho do vidro. O composto é também utilizado para reduzir as fugas de raios-X a partir de tubos de raios catódicos (CRT) aparelhos de TV.
- Bário, tipicamente como nitrato de bário, é adicionada aos fogos de artifício para dar-lhes uma cor verde. As espécies responsáveis pelo verde brilhante é bário monochloride; na ausência de cloro um verde "maçã" amarelo ou é produzido em seu lugar.
- Peróxido de bário pode ser usada como um catalisador para iniciar uma reacção aluminotérmica ao soldar carris juntos. Ele também pode ser usado em verde munições traçador e como agente de branqueamento.
- Titanato de bário é um promissor eletrocerâmicos.
- Fluoreto de bário é usado para o sistema ótico em aplicações de infravermelhos por causa de sua ampla gama de transparência 0,15-12 micrômetros.
- YBCO foi o primeiro supercondutor de alta temperatura que pode ser arrefecida por azoto líquido, como a sua temperatura de transição de 93 K (-180,2 ° C; -292,3 ° F) excedido o ponto de ebulição do azoto (77 K, -196,2 ° C; -321,1 ° F) .
Perigos biológicos e precauções
Por causa da alta reactividade do metal, os dados toxicológicos estão disponíveis somente para os compostos. Compostos de bário solúveis em água são venenosas. Em doses baixas, iões bário actuar como um estimulante do músculo, enquanto que doses mais elevadas afectam a sistema nervoso, provocando irregularidades cardíaca, tremores, fraqueza, ansiedade, dispnéia e paralisia. Isto pode ser devido à capacidade de bloquear o Ba 2+ canais de iões de potássio, que são cruciais para o funcionamento adequado do sistema nervoso. Outros órgãos-alvo para compostos de bário solúveis em água (ou seja, íons bário) são os olhos, sistema imunológico, coração, sistema respiratório e pele. Eles afetam o corpo fortemente, fazendo com que, por exemplo, cegueira e sensibilização.
Bário não é cancerígeno, e isso não acontece bioacumulação. No entanto, o pó inalado contendo compostos de bário insolúveis podem acumular-se nos pulmões, causando condição benigna chamada baritosis. Por comparação com os venenos solúveis, o sulfato insolúvel não é tóxico e não é, portanto classificado como um produto perigoso.
Para evitar uma reacção química potencialmente vigorosa, o metal de bário é mantida sob árgon ou óleos minerais. Contacto com o ar é perigoso, pois pode causar ignição. Umidade, fricção, calor, faíscas, chamas, choques, electricidade estática, reações com oxidantes e ácidos devem ser evitados. Tudo o que podem fazer contato com bário deve ser aterrado. Aqueles que trabalham com o metal deve usar sapatos de pré-limpos que não produzam faíscas, roupas de borracha resistentes ao fogo, luvas de borracha, avental, óculos de proteção e uma máscara de gás; eles não estão autorizados a fumar na área de trabalho e devem lavar-se depois de manusear bário.
