
Cromo
Sabías ...
SOS Children produjo este sitio web para las escuelas, así como este sitio web video sobre África . SOS Niño patrocinio es cool!
| Cromo | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
24 Cr | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||
metálico plateado  | ||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | cromo, Cr, 24 | |||||||||||||||||||||||||||||||||||||||
| Pronunciación | / k r oʊ m yo ə m / KROH -mee-əm | |||||||||||||||||||||||||||||||||||||||
| Categoría metálico | metal de transición | |||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 6, 4, d | |||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 51,9961 (6) | |||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 3d 5 4s 1 2, 8, 13, 1 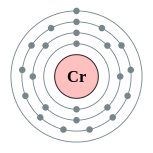 | |||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Louis Nicolas Vauquelin (1797) | |||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Louis Nicolas Vauquelin (1798) | |||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 7,19 g · cm -3 | |||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 6.3 g · cm -3 | |||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 2180 K , 1907 ° C, 3465 ° F | |||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2944 K, 2671 ° C, 4840 ° F | |||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 21.0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 339.5 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 23.35 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 6, 5, 4, 3, 2, 1, -1, -2 (Fuertemente ácida óxido) | |||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,66 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 652.9 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Segundo: 1590,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||
| Tercero: 2987 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 128 pm | |||||||||||||||||||||||||||||||||||||||
| Radio covalente | 139 ± 17:00 | |||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  | |||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | AFM (más bien: SDW) | |||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 125 nΩ · m | |||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 93,9 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 4,9 micras · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 5940 m · s -1 | |||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 279 GPa | |||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 115 GPa | |||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 160 GPa | |||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.21 | |||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 8.5 | |||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 1060 MPa | |||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 1120 MPa | |||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-47-3 | |||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de cromo | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
El cromo es un elemento químico que tiene el símbolo Cr y número atómico 24. Es el primer elemento Grupo 6. Es un acerado-gris, brillante, disco de metal que tiene un buen pulido y tiene un alto punto de fusión. También es inodoro, insípido, y maleable. El nombre del elemento se deriva del griego palabra "Chroma" (χρώμα), es decir, el color , ya que muchos de sus compuestos son de color intenso.
El óxido de cromo fue utilizado por los chinos en la dinastía Qin hace más de 2.000 años a las armas escudo de metal que se encuentran con la Ejército de Terracota. El cromo fue descubierto como un elemento después de que llegó a la atención del mundo occidental en el mineral cristalino de color rojo crocoíta ( plomo (II) cromato), descubierto en 1761 y en un principio se utiliza como pigmento . Louis Nicolas Vauquelin aislado por primera vez de metal cromo de este mineral en 1797. Desde la primera producción de Vauquelin de cromo metálico, pequeñas cantidades de nativo (gratis) de metal de cromo se han descubierto en los minerales raros, pero estos no se utilizan comercialmente. En lugar de ello, casi todos de cromo se extrae comercialmente a partir del mineral comercialmente viable sola cromita, que es óxido de cromo hierro (FeCr 2 O 4). Cromita es también ahora la principal fuente de cromo para los pigmentos de cromo.
Metal de cromo y aleación de ferrocromo se produce comercialmente a partir de cromita por silicothermic o reacciones aluminotérmicas, o por tostado y procesos de lixiviación. Metal de cromo ha demostrado de gran valor debido a su alta a la corrosión y resistencia dureza. Un desarrollo importante fue el descubrimiento de que se podría hacer de acero altamente resistente a la corrosión y la decoloración mediante la adición de cromo metálico para formar acero inoxidable. Esta aplicación, junto con cromado ( galvanoplastia con cromo) comprenden actualmente el 85% de la utilización comercial para el elemento, con las aplicaciones para compuestos de cromo que forman el resto.
Trivalente de cromo (Cr (III)) se pueden exigirse iones en cantidades traza de azúcar y lípidos metabolismo, aunque el tema sigue en debate. En grandes cantidades y en diferentes formas, cromo puede ser tóxico y cancerígenos. El ejemplo más prominente de cromo tóxico es cromo hexavalente (Cr (VI)). Centros de producción de cromo abandonados a menudo requieren limpieza ambiental.
Características
Físico
El cromo es notable por sus propiedades magnéticas: es la única elemental sólido que muestra pedido antiferromagnético a temperatura ambiente (y abajo). Por encima de 38 ° C, se transforma en un estado paramagnético.
La pasivación
El cromo metálico quedó en pie en el aire es pasivado por oxígeno , formando una capa protectora fina superficie de óxido. Esta capa es una estructura sólo unos pocos átomos de espesor espinela. Es muy densa, y evita la difusión del oxígeno en el material subyacente. Esta barrera está en contraste con hierro o de carbono llanura aceros, donde el oxígeno migra en el material y las causas subyacentes oxidación. La pasivación puede ser mejorada por el contacto corto con ácidos oxidantes como el ácido nítrico . Cromo pasivado es estable frente a los ácidos. El efecto opuesto se puede lograr mediante tratamiento con una fuerte agente que destruye la capa de óxido protectora sobre el metal reductor. El cromo metal tratado de esta manera se disuelve fácilmente en ácidos débiles.
El cromo, a diferencia de los metales, como el hierro y el níquel, no sufrir de fragilización por hidrógeno. Sin embargo, no sufren de nitrógeno fragilización, que reacciona con el nitrógeno del aire y la formación de nitruros frágil a las altas temperaturas necesarias para trabajar las piezas de metal.
Aparición


El cromo es el más 24o abundante elemento en la corteza terrestre con una concentración media de 100 ppm. Los compuestos de cromo se encuentran en el medio ambiente, debido a la erosión de las rocas que contienen cromo y se puede distribuir por las erupciones volcánicas. Las concentraciones oscilan en el suelo es entre 1 y 3000 mg / kg, en agua de mar 5-800 g / litro, y en ríos y lagos 26 g / litro a 5,2 mg / litro. El cromo se extrae como cromita (FeCr 2 O 4) mineral. Alrededor de dos quintas partes de los minerales de cromo y sus concentrados en el mundo se producen en África del Sur , mientras que Kazajstán , India , Rusia y Turquía también son productores importantes. Depósitos de cromita sin explotar son abundantes, pero geográficamente concentrada en Kazajstán y el sur de África.
Aunque es raro, depósitos de existe cromo nativo. La Udachnaya Pipe en Rusia produce muestras del metal nativo. Esta mina es una chimenea de kimberlita, rica en diamantes , y la la reducción de medio ambiente ayudó a producir tanto cromo elemental y diamantes .
La relación entre Cr (III) y Cr (VI) depende fuertemente de pH y propiedades oxidativas del lugar, pero en la mayoría de los casos, el Cr (III) es la especie dominante, aunque en algunas zonas el agua subterránea puede contener hasta 39 mg / litro de cromo total, de ellas 30 mg / litro está presente como Cr ( VI).
Isótopos
Naturalmente cromo ocurre se compone de tres estables isótopos ; 52 Cr, 53 Cr y Cr 54 con 52 Cr siendo el más abundante (83,789% abundancia natural). 19 radioisótopos se han caracterizado con ser más estable Cr 50 con una vida media de (más de) 1,8 × 10 17 años, y 51 Cr con una vida media de 27,7 días. Todos los restantes isótopos radiactivos tienen vidas medias que son menos de 24 horas y la mayoría de ellos tienen vidas medias que son menos de 1 minuto. Este elemento también tiene 2 estados de la meta.
53 Cr es el producto de la desintegración radiogénico de 53 Mn . Cromo isotópicas contenidos se combinan típicamente con manganeso contenidos isotópicos y han encontrado aplicación en geología isotópica. Mn proporciones de isótopos -Cr refuerzan la evidencia de los 26 de Al y 107 Pd para la historia temprana del Sistema Solar . Las variaciones en 53 Cr / 52 Cr y Mn / Cr proporciones de varios meteoritos indican un 53/55 Mn Mn relación inicial que sugiere que Mn-Cr composición isotópica debe resultar de la descomposición in situ de 53 Mn en cuerpos planetarios diferenciadas. Por lo tanto 53 Cr proporciona evidencia adicional para procesos de nucleosíntesis inmediatamente antes de la coalescencia del sistema solar.
Los isótopos de cromo varían en masa atómica de 43 u (43 Cr) a 67 u (67 Cr). El primario modo de decaimiento antes del isótopo estable más abundante, 52 Cr, es captura de electrones y el modo primario después de que se la desintegración beta. 53 Cr se ha postulado como sustituto de la concentración de oxígeno atmosférico.
Compuestos
| Oxidación estados | |
|---|---|
| -2 | Na 2 [Cr (CO) 5] |
| -1 | Na 2 [2 Cr (CO) 10] |
| 0 | Cr (C 6 H 6) 2 |
| 1 | K 3 [Cr (CN) 5 NO] |
| 2 | ClCr 2 |
| 3 | CrCl3 |
| 4 | K 2 CrF 6 |
| 5 | K CrO 3 8 |
| 6 | K 2 CrO 4 |
El cromo es un miembro de los metales de transición , en grupo 6. El cromo (0) tiene una configuración electrónica de 4s 1 3d 5, debido a la menor energía de la configuración de alta rotación. El cromo exhibe una amplia gama de posibles estados de oxidación , donde el estado 3 es más estable energéticamente; los 3 y 6 estados se observan con mayor frecuencia en los compuestos de cromo, mientras que las 1, 4 y 5 estados son raros.
El siguiente es el Diagrama de Pourbaix para el cromo en agua pura, ácido perclórico o hidróxido de sodio: 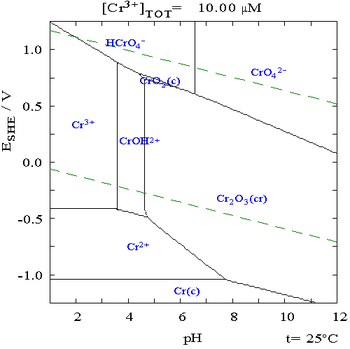
El cromo (III)


Se conoce un gran número de cromo (III) compuestos. El cromo (III) se puede obtener mediante la disolución de cromo elemental en ácidos como ácido clorhídrico o ácido sulfúrico . El ion Cr 3+ tiene un radio similar (63 pm) a la 3+ iones Al (radio de 50 pm), por lo que pueden sustituir entre sí en algunos compuestos, tal como en alumbre de cromo y alumbre. Cuando una cantidad traza de Cr 3+ reemplaza Al 3+ en corindón (óxido de aluminio, Al 2 O 3), el de color rojo rubí se forma.
El cromo iones (III) tienden a formar complejos octaédricos. Los colores de estos complejos se determina por los ligandos unidos al centro Cr. El disponible comercialmente de cromo (III) cloruro de hidrato es el complejo de color verde oscuro [CrCl 2 (H 2 O) 4] Cl. Compuestos estrechamente relacionados tienen diferentes colores: verde pálido [CrCl (H 2 O) 5] Cl 2 y el violeta [Cr (H2O) 6] Cl 3. Si verde libre de agua cloruro de cromo (III) se disuelve en agua y luego la solución de color verde se vuelve violeta después de algún tiempo, debido a la sustitución del agua por cloruro en el interior esfera de coordinación. Este tipo de reacción también se observa con soluciones de alumbre de cromo y otras sales de cromo soluble en agua (III).
El cromo (III) de hidróxido de (Cr (OH) 3) es anfótero, disolver en soluciones ácidas para formar [Cr (H 2 O) 6] 3+, y en soluciones básicas para formar [Cr (OH) 6] 3-. Se deshidrató por calentamiento para formar el verde cromo (III) óxido (Cr 2 O 3), que es el óxido estable con una estructura cristalina idéntica a la de corindón .
El cromo (VI)

El cromo (VI) son compuestos oxidantes poderosos a pH bajo o neutro. Los más importantes son anión cromato (CrO 2-
4) y dicromato (Cr 2 O 7 2-) aniones, que existen en equilibrio:
- 2 [CrO 4] 2- + 2 H +
 [Cr 2 O 7] 2- + H 2 O
[Cr 2 O 7] 2- + H 2 O
Cromo (VI) haluros son conocidos también e incluyen la hexafluoruro CrF 6 y cloruro cromilo (CrO 2 Cl 2).
El cromato sódico se produce industrialmente por la calcinación oxidativa de mineral de cromita con calcio o carbonato de sodio. Por tanto, la especie dominante es, por el la ley de acción de masas, determinado por el pH de la solución. El cambio en el equilibrio es visible por un cambio de amarillo (cromato) a naranja ( dicromato), tal como cuando se añade un ácido a una solución neutra de cromato de potasio. A valores de pH más bajos aún, más condensación para más compleja oxianiones de cromo es posible.
Tanto los aniones Cromato son fuertes reactivos oxidantes a pH bajo:

- Cr 2 O 2-
7 + 14 H 3 O + + 6 e - → 2 Cr 3+ + 21 H 2 O (ε 0 = 1,33 V)
Ellos son, sin embargo, sólo moderadamente oxidante a pH alto:
- CrO 2-
4 + 4 H 2 O + 3 e - → Cr (OH) 3 + 5 OH - (ε 0 = -0,13 V)
Compuestos de cromo (VI) en solución pueden ser detectados por la adición de un ácido peróxido de hidrógeno solución. El azul oscuro inestable cromo (VI) de peróxido (CrO 5) está formado, que puede ser estabilizado como un aducto de éter CrO 5 · O 2.
Ácido crómico tiene la fórmula hipotética H 2 CrO 4. Es una sustancia química se describe vagamente, a pesar de se conocen muchos cromatos y dicromatos bien definidos. El rojo oscuro cromo (VI) óxido de CrO 3, el ácido anhídrido de ácido crómico, se vende industrialmente como "ácido crómico". Puede ser producido mediante la mezcla de ácido sulfúrico con dicromato, y es un agente oxidante fuerte.
El cromo (V) y cromo (IV)
El estado de oxidación 5 sólo se realiza en pocos compuestos, pero son intermedios en muchas reacciones que implican oxidaciones por cromato. El único compuesto binario es el cromo volátil (V) de fluoruro (CRF 5). Este sólido rojo tiene un punto de fusión de 30 ° C y un punto de ebullición de 117 ° C. Se puede sintetizarse mediante el tratamiento de metal de cromo con flúor a 400 ° C y 200 bar de presión. El peroxochromate (V) es otro ejemplo del estado de oxidación +5. Peroxochromate de potasio (K 3 [Cr (O 2) 4]) se prepara haciendo reaccionar cromato de potasio con peróxido de hidrógeno a bajas temperaturas. Este compuesto marrón rojo es estable a temperatura ambiente, pero se descompone espontáneamente a 150-170 ° C.
Los compuestos de cromo (IV) (en el estado de oxidación +4) son ligeramente más común que los de cromo (V). Los tetrahaluros, el CRF 4, CrCl 4, y CRBR 4, pueden ser producidos por tratamiento de los trihaluros (CRX 3) con el halógeno correspondiente a temperaturas elevadas. Tales compuestos son susceptibles a reacciones de desproporción y no son estables en agua.
El cromo (II)
Muchos compuestos de cromo (II) son conocidos, incluyendo el agua estable cromo (II), cloruro de CrCl 2, que puede hacerse por reducción de cromo (III) cloruro con zinc. La solución de color azul brillante resultante sólo es estable a neutral pH. Muchos carboxilatos cromosas también son conocidos, lo más famoso, el rojo acetato cromoso (Cr 2 (O 2 CCH 3) 4), que cuenta con un enlace cuádruple.
Cromo (I)
La mayoría de los compuestos de Cr (I) se obtienen por oxidación de rico en electrones, octaédricos Cr (0) complejos. Otros complejos de Cr (I) contienen ligandos de ciclopentadienilo. Como verificada por Difracción de rayos X, una Cr-Cr Enlace quíntuple (longitud 183.51 (4) pm) también se ha descrito. Extremadamente ligandos monodentados voluminosos estabilizan este compuesto mediante el blindaje del enlace quíntuple de reacciones adicionales.

El cromo (0)
Muchos de cromo (0) compuestos son conocidos. La mayoría son derivados de hexacarbonilo de cromo o bis (benceno) cromo.
Historia
Las armas encontradas en fosas comunes que datan de finales del siglo 3 aC Dinastía Qin del Ejército de Terracota cerca Xi'an, China, han sido analizados por los arqueólogos. Aunque enterrado hace más de 2.000 años, la antigua consejos de bronce de ballestas y espadas encontradas en el lugar mostraron inesperadamente poca corrosión, posiblemente debido a que el bronce fue revestida deliberadamente con una fina capa de óxido de cromo. Sin embargo, esta capa de óxido era de metal o cromo de placas no cromo como la conocemos.
Minerales de cromo como pigmentos llamaron la atención de Occidente en el siglo 18. El 26 de julio de 1761, Johann Gottlob Lehmann encontró un mineral de color rojo anaranjado en el Minas Beryozovskoye en el Montes Urales que denominó plomo rojo de Siberia. Aunque identificado erróneamente como un plomo compuesto con selenio y hierro componentes, el mineral era de hecho crocoíta ( cromato de plomo) con una fórmula de PbCrO 4.
En 1770, Peter Simon Pallas visitó el mismo lugar que Lehmann y encontró un mineral rojo de plomo que tenía propiedades útiles como pigmento en pinturas. El uso de plomo rojo de Siberia como un pigmento de pintura entonces se desarrolló rápidamente. Un brillante pigmento amarillo hecha de crocoíta también se puso de moda.

En 1797, Louis Nicolas Vauquelin recibió muestras de crocoíta mena. Produjo trióxido de cromo (CrO 3) mediante la mezcla de crocoíta con ácido clorhídrico . En 1798, Vauquelin descubrió que se podía aislar cromo metálico calentando el óxido en un horno de carbón, haciendo de él el descubridor del elemento. Vauquelin también fue capaz de detectar trazas de cromo en preciosa piedras preciosas, tales como rubí o esmeralda.
Durante la década de 1800, el cromo se utiliza principalmente como un componente de pinturas y en sales de curtido. Al principio, crocoíta de Rusia fue la fuente principal, pero en 1827, un depósito de cromita grande fue descubierto cerca Baltimore, Estados Unidos . Esto hizo que los Estados Unidos, el mayor productor de productos de cromo hasta 1848, cuando se encontraron grandes depósitos de cromita cerca Bursa, Turquía .
El cromo también es conocida por su brillo cuando pulido. Se utiliza como una capa protectora y decorativa de piezas de automóviles, accesorios de plomería, partes de muebles y muchos otros artículos, por lo general aplicada por galvanoplastia. El cromo se utiliza para la galvanoplastia tan pronto como 1848, pero este uso sólo se generalizó con el desarrollo de un procedimiento mejorado en 1924.
Aleaciones metálicas ahora representan el 85% del uso de cromo. El resto se utiliza en el industria química y refractario y industrias de fundición.
Producción



Aproximadamente 4,4 millones de toneladas métricas de mineral de cromita comercializable se produjeron en el año 2000, y se convierten en ~ 3,3 millones de toneladas de ferro-cromo con un valor de mercado aproximado de 2,5 mil millones de dólares de los Estados Unidos . Los mayores productores de mineral de cromo han sido Sudáfrica (44%) India (18%), Kazajstán (16%) Zimbabwe (5%), Finlandia (4%) Irán (4%) y Brasil (2%) con varios otros países productores el resto de menos de 10% de la producción mundial.
Los dos principales productos de la refinación del mineral de cromo son ferrocromo y el cromo metálico. Para los productos del proceso de fundición de mineral difiere considerablemente. Para la producción de ferrocromo, el mineral de cromita (FeCr 2 O 4) se reduce en gran escala en horno de arco eléctrico o en fundiciones más pequeñas con ya sea de aluminio o de silicio en una reacción aluminotérmica.

Para la producción de cromo puro, el hierro tiene que ser separado del cromo en un proceso de dos etapas de calcinación y de lixiviación. El mineral de cromita se calienta con una mezcla de carbonato de calcio y carbonato de sodio en la presencia de aire. El cromo se oxida a la forma hexavalente, mientras que el hierro forma estable el Fe 2 O 3. La lixiviación posterior a temperaturas superiores elevadas disuelve la cromatos y deja el óxido de hierro insoluble. El cromato se convierte por el ácido sulfúrico en el dicromato.
- 4 FeCr 2 O 4 + 8 Na 2 CO 3 + 7 O 2 → 8 Na 2 CrO 4 + 2 Fe 2 O 3 + 8 CO 2
- 2 Na 2 CrO 4 + H 2 SO 4 → Na 2 Cr 2 O 7 + Na 2 SO 4 + H 2 O
El dicromato se convierte en el óxido de cromo (III) por reducción con carbono y luego se reduce en una reacción aluminotérmica al cromo.
- Na 2 Cr 2 O 7 + 2 C → Cr 2 O 3 + Na 2 CO 3 + CO
- Cr 2 O 3 + 2 Al → Al 2 O 3 + 2 Cr
Aplicaciones
Metalurgia

El efecto fortalecimiento de la formación de carburos metálicos estables en los límites de grano y el fuerte aumento de la resistencia a la corrosión hecha de un material de aleación de cromo importante para el acero. La aceros para herramientas de alta velocidad contienen entre 3 y 5% de cromo. Se forma cuando se añade cromo al acero inoxidable, la aleación principal a prueba de corrosión de metal, hierro en concentraciones suficientes, por lo general por encima de 11%. Para su formación, se añade ferrocromo al hierro fundido. También aleaciones a base de níquel aumentan en fuerza debido a la formación de partículas de carburo de metal, estables discretos en los límites de grano. Por ejemplo, Inconel 718 contiene 18,6% de cromo. Debido a las excelentes propiedades de alta temperatura de estas níquel superaleaciones, que se utilizan en motores de reacción y turbinas de gas en lugar de los materiales estructurales comunes.
La alta dureza y resistencia a la corrosión relativa de cromo puro hace que sea un buen recubrimiento de superficie, siendo aún el más recubrimiento metálico "popular" con mayor durabilidad incomparable. Una fina capa de cromo se deposita sobre superficies metálicas pretratadas por técnicas de galvanoplastia. Hay dos métodos de deposición: Thin, por debajo de 1 m de espesor, las capas se depositan por cromado, y se utilizan para superficies decorativas. Si se necesitan superficies resistentes al desgaste a continuación, se depositan capas de cromo más gruesas. Ambos métodos utilizan normalmente cromato ácido o soluciones de dicromato. Para evitar el cambio consumidores de energía en estado de oxidación, el uso de cromo (III) sulfato está en desarrollo, pero para la mayoría de las aplicaciones, se utiliza el proceso establecido.
En el proceso de revestimiento de conversión de cromato, las fuertes propiedades oxidativas de cromatos se utilizan para depositar una capa protectora de óxido en metales como el aluminio, el zinc y el cadmio. Este pasivación y las propiedades de auto-sanación por el cromato almacenado en el revestimiento de conversión de cromato, que es capaz de migrar a defectos locales, son los beneficios de este método de recubrimiento. Debido a las regulaciones ambientales y de salud en cromatos, método de recubrimiento alternativa están en desarrollo.
El anodizado del aluminio es otro proceso electroquímico, que no conduce a la deposición de cromo, pero usos ácido crómico como electrolito en la solución. Durante la anodización, se forma una capa de óxido sobre el aluminio. El uso de ácido crómico, en lugar del ácido sulfúrico usado normalmente, conduce a una ligera diferencia de estas capas de óxido. La alta toxicidad del Cr (VI), que se utiliza en el proceso de galvanoplastia de cromo establecido, y el fortalecimiento de la seguridad y regulaciones ambientales exigen una búsqueda de sustitutos para el cromo o al menos un cambio en cromo menos tóxicos (III) compuestos.
Dye y pigmento

El mineral crocoíta ( plomo PbCrO cromato 4) se utilizó como un pigmento amarillo poco después de su descubrimiento. Después de un método de síntesis se hizo disponible a partir de la más abundante de cromita, amarillo de cromo fue, junto con amarillo de cadmio, uno de los pigmentos amarillos más utilizados. El pigmento no fotodegrada, pero tiende a oscurecerse debido a la formación de cromo (III) de óxido. Tiene un color fuerte, y se utilizó para los autobuses escolares en los EE.UU. y para el Servicio Postal (por ejemplo, Deutsche Post) en Europa. El uso de amarillo de cromo se negó debido a las preocupaciones ambientales y de seguridad y fue reemplazado por pigmentos orgánicos o alternativas libres de plomo y cromo. Otros pigmentos a base de cromo son, por ejemplo, el color rojo brillante rojo de cromo pigmento, que es un cromato básico de plomo (PbCrO 4 · Pb (OH) 2). Un pigmento de cromato muy importante, que se usó ampliamente en formulaciones de imprimación metal, era cromato de zinc, sustituido ahora por el fosfato de zinc. Un cebador de lavado se formula para sustituir la práctica peligrosa de pretratamiento de cuerpos de aviones de aluminio con una solución de ácido fosfórico. Este tetroxychromate zinc utilizado dispersado en una solución de butiral de polivinilo. Una solución de 8% de ácido fosfórico en disolvente se añade justo antes de la aplicación. Se encontró que un alcohol fácilmente oxidado era un ingrediente esencial. Se aplicó una capa delgada de alrededor de 10-15 micras, que se volvió de amarillo a verde oscuro cuando se curó. Todavía hay una pregunta sobre el mecanismo correcto. Verde Chrome es una mezcla de Azul de Prusia y cromo amarillo, mientras que el verde óxido de cromo es óxido de cromo (III).
Óxidos de cromo se utilizan también como un color verde en la fabricación de vidrio y como un esmalte en cerámica. Óxido de cromo verde es extremadamente resistente a la luz y como tal se utiliza en revestimientos de revestimiento. También es el principal ingrediente de reflexión IR pinturas, utilizados por las fuerzas armadas, para pintar los vehículos, para darles la misma reflectancia IR como las hojas verdes.
Rubí sintético y el primer láser
Natural rubíes son corindón (óxido de aluminio) cristales que son de color rojo (el tipo más raro) debido a cromo (III) iones (otros colores de gemas de corindón se denominan zafiros). Un rubí artificial de color rojo también puede lograrse por el dopaje de cromo (III) en cristales de corindón artificial, haciendo así un requisito de cromo para la fabricación de los rubíes sintéticos. Tal cristal de rubí sintético fue la base para el primer láser , producido en 1960, que se basó en emisión estimulada de la luz de los átomos de cromo en un cristal tal.
Conservante de la madera
Debido a su toxicidad, el cromo (VI) sales se usan para la preservación de la madera. Por ejemplo, arseniato de cobre cromado (CCA) se utiliza en tratamiento de la madera para proteger la madera de hongos de pudrición, insectos xilófagos, incluidas las termitas , y la polilla de mar. Las formulaciones contienen cromo basado en el óxido de CrO 3 entre 35,3% y 65,5%. En los Estados Unidos, 65.300 toneladas métricas de solución CCA se han utilizado en 1996.
Curtido
Cromo (III), especialmente sales alumbre de cromo y cromo (III) sulfato, se utilizan en la curtido de cuero. El cromo (III) estabiliza el cuero por la reticulación fibras de colágeno. El cromo cuero curtido puede contener entre 4 y 5% de cromo, que está fuertemente unido a las proteínas. Aunque la forma de cromo se utiliza para el bronceado no es la variedad hexavalente tóxico, sigue habiendo interés en la gestión de cromo en la industria del curtido como la recuperación y la reutilización, el reciclado directo / indirecto, uso de menos de cromo o curtido "cromo-menos" se practican para gestionar mejor el cromo en el curtido.
Material refractario
La alta resistencia al calor y las altas marcas de punto de fusión cromita y el cromo (III) óxido de un material de alta temperatura para aplicaciones refractarias, como altos hornos, cemento hornos, moldes para la cocción de ladrillos y arenas de fundición como para el fundición de metales. En estas aplicaciones, los materiales refractarios están hechos de mezclas de cromita y magnesita. El uso está disminuyendo debido a las regulaciones ambientales debido a la posibilidad de la formación de cromo (VI).
Catalizadores
Varios compuestos de cromo se utilizan como catalizadores para los hidrocarburos de procesamiento. Por ejemplo, la Catalizadores de Phillips para la producción de polietileno son mezclas de cromo y dióxido de silicio o mezclas de cromo y titanio y óxido de aluminio . Fe-Cr óxidos mixtos se emplean como catalizadores de alta temperatura para la reacción de desplazamiento del gas de agua. Cromito de cobre es un útil de hidrogenación del catalizador.
Otro uso
- El cromo (IV) óxido (CrO 2) es una magnético compuesto. Su forma ideales anisotropía, que imparte alta coercitividad y magnetización remanente, hicieron un compuesto superior a la γ-Fe 2 O 3. El cromo (IV) óxido se utiliza para fabricar cinta magnética usada en cinta de audio de alto rendimiento y estándar casetes de audio. Cromatos pueden evitar la corrosión de acero bajo condiciones de humedad, y por lo tanto cromatos se añadió a los lodos de perforación.
- El cromo (III) es un óxido de metal pulido conocido como rouge verde.
- El ácido crómico es un potente agente oxidante y es un compuesto útil para la limpieza de vidrio de laboratorio de cualquier rastro de compuestos orgánicos. Se prepara in situ por disolución de dicromato de potasio en ácido sulfúrico concentrado, que luego se utiliza para lavar el aparato. Dicromato de sodio se utiliza a veces debido a su solubilidad superior (50 g / L frente a 200 g / L respectivamente). Dicromato de potasio es un producto químico reactivo, utilizado en la limpieza vidrio de laboratorio y como un agente de titulación. También se utiliza como una mordiente (es decir, un agente de fijación) para los colorantes en la tela.
Papel biológico
El cromo trivalente (Cr (III) o Cr 3+) se produce en cantidades traza en los alimentos y las aguas, y parece ser benigno. En contraste, cromo hexavalente (Cr (VI) o Cr 6+) es muy tóxico y mutagénico cuando se inhala. Cr (VI) no se ha establecido como un carcinógeno cuando está en solución, aunque puede causar alergia dermatitis de contacto (ACD).
La deficiencia de cromo, que implica una falta de Cr (III) en el cuerpo, o quizás algún complejo de la misma, tales como factor de tolerancia a la glucosa es controvertido, o al menos muy poco frecuente. El cromo no ha verificado papel biológico y ha sido clasificado por algunos como no esencial para los mamíferos. Sin embargo, otros han considerado como un elemento traza esencial en los seres humanos.

La deficiencia de cromo se ha atribuido a sólo tres personas en largo plazo nutrición parenteral, que es cuando un paciente es alimentado con una dieta líquida a través de goteos intravenosos durante largos períodos de tiempo.
Aunque ningún papel biológico para el cromo nunca se ha demostrado, los suplementos dietéticos para el cromo incluyen picolinato de cromo (III), cromo polinicotinato (III), y materiales relacionados. El beneficio de estos suplementos es cuestionada por algunos estudios. El uso de suplementos dietéticos que contienen cromo es controversial, debido a la ausencia de cualquier papel verificado biológica, el gasto de estos suplementos, y los complejos efectos de su uso. El suplemento dietético popular complejo de cromo picolinato genera daño cromosómico en células de hámster (debido al ligando picolinato). En los Estados Unidos las directrices dietéticas para la captación de cromo diariamente se redujeron en 2001 50-200 mg para un adulto de 35 mg (varones adultos) y 25 mg (hembra adulta).
Precauciones
De cromo (III) insoluble agua y compuestos de metal de cromo no son considerados un peligro para la salud, mientras que la toxicidad y las propiedades cancerígenas de cromo (VI) se conocen desde hace mucho tiempo. Debido a los mecanismos de transporte específicas, sólo cantidades limitadas de cromo (III) entrar en las células. Varios estudios in vitro indicaron que las altas concentraciones de cromo (III) en la célula puede conducir a daños en el ADN. Toxicidad oral aguda oscila entre 1,5 y 3,3 mg / kg. Los efectos beneficiosos propuestos de cromo (III) y el uso como suplementos dietéticos dado algunos resultados controvertidos, pero recientes sugieren que la absorción moderada de cromo (III) a través de suplementos dietéticos no representa ningún riesgo.
Cr (VI)
La aguda oral toxicidad para el cromo (VI) oscila entre 50 y 150 g / kg. En el cuerpo, el cromo (VI) se reduce por varios mecanismos a cromo (III) ya en la sangre antes de que entre las células. El cromo (III) se excreta del cuerpo, mientras que el ion cromato se transfiere a la célula por un mecanismo de transporte, por lo que también sulfato y iones fosfato entran en la célula. La toxicidad aguda del cromo (VI) es debido a su fuerte propiedades oxidational. Después de que llegue a la corriente de la sangre, que daña los riñones, las células del hígado y de la sangre a través de reacciones de oxidación. La hemólisis, renal e insuficiencia hepática son los resultados de estos daños. Diálisis agresiva puede mejorar la situación.
La carcinogenicidad de polvo de cromato es conocido por un largo tiempo, y en 1890 la primera publicación describe el riesgo elevado de cáncer de los trabajadores en una empresa de tinte cromato. Se han propuesto tres mecanismos para describir la genotoxicidad de cromo (VI). El primer mecanismo incluye altamente reactiva radicales hidroxilo y otros radicales reactivos que son subproductos de la reducción de cromo (VI) a cromo (III). El segundo procedimiento incluye la unión directa de cromo (V), producido por la reducción en la célula, y el cromo (IV) compuestos al ADN . El último mecanismo atribuyó la genotoxicidad a la unión al ADN del producto final de la cromo (III) de reducción.
Sales de cromo (cromatos) son también la causa de reacciones alérgicas en algunas personas. Cromatos a menudo se utilizan para la fabricación de, entre otras cosas, productos de cuero, pinturas, cemento, mortero y anticorrosivos. Póngase en contacto con productos que contienen cromatos pueden conducir a alérgica dermatitis de contacto y dermatitis irritante, lo que resulta en la ulceración de la piel, se hace referencia a veces como "úlceras de cromo". Esta condición se encuentra a menudo en los trabajadores que han estado expuestos a fuertes soluciones de cromato de galvanoplastia, curtido y fabricantes de cromo productoras.
Las cuestiones ambientales
Como se utilizan compuestos de cromo en colorantes y pinturas y la curtido de cuero, estos compuestos se encuentran a menudo en el suelo y las aguas subterráneas en los emplazamientos industriales abandonados, ahora necesitan limpieza del medio ambiente y remediación por el tratamiento de la terrenos abandonados. Pintura base contiene cromo hexavalente es aún ampliamente utilizado para aeroespacial y automotriz renovación del acabado de aplicaciones.
En 2010, el Grupo de Trabajo Ambiental estudió el agua potable en 35 ciudades de Estados Unidos. El estudio fue el primero análisis a nivel nacional medir la presencia de la sustancia química en sistemas de agua de los Estados Unidos. El estudio encontró cromo hexavalente medible en el agua del grifo de 31 de las ciudades muestreada, con Norman, Oklahoma, en la parte superior de la lista; 25 ciudades presentaron niveles que excedieron límite propuesto de California. Nota: Las concentraciones de Cr (VI) en los Estados Unidos las reservas de agua potable municipales reportados por EWG están dentro probables, niveles naturales de referencia de las áreas a prueba y no es necesariamente indicativa de la contaminación industrial (Hoja Informativa CalEPA), como afirma EWG. Este factor no se tuvo en cuenta en su informe.
