
Americio
Acerca de este escuelas selección Wikipedia
Esta selección se hace para las escuelas por caridad para niños leer más . Apadrinar un niño para hacer una diferencia real.
| Americio | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
95 Am | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||
blanco plateado  | |||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | americio, Am, 95 | ||||||||||||||||||||||||||||||||||||
| Pronunciación | / ˌ æ m ə r ɪ s yo ə m / AM -ə- RIS -ee-əm | ||||||||||||||||||||||||||||||||||||
| Categoría metálico | actínidos | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 7, F | ||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | (243) | ||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 7 7s 2 2, 8, 18, 32, 25, 8, 2 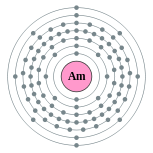 | ||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||
| Descubrimiento | Glenn T. Seaborg, Ralph A. James, Leon O. Morgan, Albert Ghiorso (1944) | ||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 12 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1449 K , 1176 ° C, 2149 ° F | ||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2880 K, 2607 ° C, 4725 ° F | ||||||||||||||||||||||||||||||||||||
| Calor de fusión | 14.39 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 62.7 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 7, 6, 5, 4, 3, 2 ( óxido anfótero) | ||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,3 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 578 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Radio atómico | 173 pm | ||||||||||||||||||||||||||||||||||||
| Radio covalente | 180 ± 18:00 | ||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal  | ||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | 0.69 μΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 10 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-35-9 | ||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de americio | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Americio (pron .: / ˌ æ m ə r ɪ s yo ə m / AM -ə- RIS -ee-əm) es un transuránicos radiactivo elemento químico que tiene el Am símbolo y número atómico 95. Este transuránicos elemento de la actínidos serie se encuentra en la tabla periódica por debajo de la de los lantánidos elemento de europio , y por lo tanto, por analogía, fue nombrado después de otro continente, América.
Americio se produjo por primera vez en 1944 por el grupo de Glenn T. Seaborg en la Universidad de California, Berkeley. Aunque es el tercer elemento de la serie transuránicos, se descubrió cuarto, después de que el más pesado el curio . El descubrimiento se mantuvo en secreto y sólo lanzado al público en noviembre se produjo el año 1945. La mayor parte del americio bombardeando uranio o plutonio con neutrones en reactores nucleares - uno tonelada de pasado combustible nuclear contiene cerca de 100 gramos de americio. Es ampliamente utilizado en comerciales cámara de ionización detectores de humo, así como en fuentes de neutrones y medidores industriales. Varias aplicaciones inusuales, como una batería nuclear o combustible para naves espaciales con propulsión nuclear, se han propuesto para el isótopo Am 242m, pero están todavía tan obstaculizada por la escasez y el alto precio de este isómero nuclear.
Americio es relativamente suave metal radiactivo con aspecto plateado. Sus isótopos más comunes son 241 Am y 243 Am. En los compuestos químicos, por lo general asumen el estado de oxidación +3, especialmente en soluciones. Varios otros estados de oxidación son conocidos, que van 2-7 y se pueden identificar por su característica Los espectros de absorción óptica. La red cristalina del sólido americio y sus compuestos contiene defectos intrínsecos, que son inducida por auto-irradiación con partículas alfa y acumular con el tiempo; esto da lugar a una deriva de algunas propiedades de los materiales.
Historia

Aunque el americio se produjo probablemente en experimentos nucleares anteriores, era primero intencionalmente sintetizado, aislado e identificado a finales de otoño de 1944, en el Universidad de California, Berkeley por Glenn T. Seaborg, Leon O. Morgan, Ralph A. James, y Albert Ghiorso. Utilizaron un 60 pulgadas ciclotrón en la Universidad de California, Berkeley. El elemento fue identificado químicamente en el Laboratorio Metalúrgico (ahora Argonne National Laboratory) de la Universidad de Chicago. Tras el ligero neptunio , plutonio , y más pesado curio , americio fue el cuarto elemento transuranium a ser descubiertos. En ese momento, la tabla periódica se había reestructurado por Seaborg a su actual diseño, que contiene la fila de actínidos por debajo de la de los lantánidos uno. Esto llevó al americio que se encuentra justo debajo de su gemelo elemento lantánido europio; fue así por analogía el nombre de otro continente, América: "El americio nombre (después de las Américas) y el símbolo Am se sugieren para el elemento sobre la base de su posición como el sexto miembro de la serie de los actínidos de tierras raras, análogo al europio, Eu, de la serie de los lantánidos."
El nuevo elemento se aisló a partir de su óxidos en un proceso de múltiples pasos complejo. En primer lugar plutonio -239 nitrato (239 puno 3) solución se revistió sobre un platino lámina de aproximadamente 0,5 cm2 de área, la solución se evaporó y el residuo se convirtió en dióxido de plutonio (PuO 2) mediante recocido. Después de la irradiación ciclotrón, el recubrimiento se disolvió con ácido nítrico , y después precipita como hidróxido utilizando acuoso concentrado solución de amoníaco. El residuo se disolvió en ácido perclórico. Además de separación se llevó a cabo por de intercambio de iones, produciendo un cierto isótopo de curio. La separación de curio y americio era tan meticuloso que esos elementos fueron llamados inicialmente por el grupo de Berkeley como pandemonium (del griego para todos los demonios o diablos) y delirio (del latín para la locura).
Los experimentos iniciales arrojaron cuatro isótopos americio: 241 Am, Am 242, 239 y 238 Am Am. Americio-241 se obtuvo directamente de plutonio tras la absorción de un neutrón. Se desintegra por emisión de una α-partícula de 237 Np; la vida media de esta descomposición se determinó por primera vez como 510 ± 20 años pero luego corrigió a 432,2 años.
- Los tiempos son vidas medias
El segundo isótopo 242 Am se produjo tras el bombardeo de neutrones del ya creado 241 Am. Tras una rápida β-decadencia, 242 Am convierte en el isótopo de curio 242 Cm (que había sido descubierto anteriormente). La vida media de este decaimiento se determinó inicialmente a las 17 horas, que era cerca del valor actualmente aceptado de 16.02 h.
El descubrimiento de americio y curio en 1944 estaba estrechamente relacionada con la Proyecto Manhattan; los resultados eran confidenciales y desclasificarse únicamente en 1945. Seaborg filtró la síntesis de los elementos 95 y 96 en el programa de radio de Estados Unidos para los niños, los Examen niños, cinco días antes de la presentación oficial en un Reunión de la American Chemical Society, el 11 de noviembre de 1945, cuando uno de los oyentes preguntó si cualquier nuevo elemento transuranium lado de plutonio y neptunio había sido descubierto durante la guerra. Tras el descubrimiento de los isótopos de americio 241 Am y 242 Am, su producción y compuestos fueron patentados lista sólo Seaborg como el inventor. Las muestras iniciales americio pesaron unos pocos microgramos; que eran apenas visibles y se identificaron por su radioactividad. Los primeros grandes cantidades de americio metálica que pesa 40 a 200 microgramos no se prepararon hasta 1951 mediante la reducción de americio (III) con fluoruro de bario de metal en alto vacío a 1100 ° C.
Aparición

Los isótopos más longevos y más comunes de americio 241, Am y 243 Am, tienen vidas medias de 432,2 y 7.370 años, respectivamente. Por lo tanto, todo americio primordial (americio que estaba presente en la Tierra durante su formación) debería haber decaído por ahora.
Americio existente se concentra en las áreas utilizadas para la atmosférica pruebas de armas nucleares realizadas entre 1945 y 1980, así como en los lugares de los incidentes nucleares, como el desastre de Chernobyl . Por ejemplo, el análisis de los restos en el sitio de ensayo de la primera de EE.UU. bomba de hidrógeno, Ivy Mike, (1 de noviembre de 1952, Enewetak Atoll), reveló altas concentraciones de varios actínidos incluyendo americio; debido al secreto militar, este resultado sólo se publicó en 1956. Trinitita, el residuo vidrioso dejó en el suelo del desierto cerca Alamogordo, Nuevo México, después de que el plutonio -basado Trinidad prueba de la bomba nuclear el 16 de julio de 1945, contiene trazas de Americio-241. También se detectaron niveles elevados de americio en el lugar del accidente de un estadounidense bombardero B-52, que llevaba cuatro bombas de hidrógeno, en 1968 en Groenlandia .
En otras regiones, la radiactividad media de la superficie del suelo debido al americio residual es de sólo 0.01 picocurios / g (0,37 mBq / g). Compuestos americio atmosféricos son poco solubles en disolventes comunes y en su mayoría se adhieren a las partículas del suelo. Análisis de suelo reveló unos 1.900 mayor concentración de americio interior partículas de suelo de arena que en el agua presente en los poros del suelo; una proporción incluso más alta se midió en suelos franco.
Americio se produce principalmente artificialmente en pequeñas cantidades, para fines de investigación. Una tonelada de combustible nuclear gastado contiene cerca de 100 gramos de varios isótopos americio, en su mayoría 241 Am y 243 Am. Su radiactividad prolongada no es deseable para la eliminación, y por lo tanto el americio, junto con otros actínidos de larga vida, tienes que estar neutralizado. El procedimiento asociado puede implicar varios pasos, en los que el americio se separa primero y luego convertidos por el bombardeo de neutrones en reactores especiales para nucleidos de corta duración. Este procedimiento es bien conocido como transmutación nuclear, pero aún está en desarrollo para el americio.
Unos pocos átomos de americio pueden ser producidos por reacciones de captura de neutrones y desintegración beta en muy alta concentración de uranio depósitos que alojan.
Síntesis y extracción
Nucleosyntheses isotópicas

Americio se ha producido en pequeñas cantidades en reactores nucleares durante décadas, y sus 241 kilos de Am y 243 Am isótopos se han acumulado por ahora. Sin embargo, desde que se ofreció por primera vez a la venta en 1962, su precio, unos 1.500 dólares por gramo de 241 Am, se mantiene casi sin cambios, debido al procedimiento de separación muy complejo. Cuanto más pesado isótopo 243 Am se produce en cantidades mucho más pequeñas; es por lo tanto más difícil de separar, lo que resulta en un mayor coste de la orden de 100-160 USD / mg.
Americio no se sintetiza directamente de uranio - el material del reactor más común - pero desde el isótopo plutonio 239 Pu. Este último necesita ser producido primero, de acuerdo con el siguiente proceso nuclear:
La captura de dos neutrones por 239 Pu (un así llamado (n, γ) de reacción), seguido de una β-decaimiento, resultados en 241 Am:
El plutonio en el combustible nuclear gastado contiene aproximadamente el 12% de 241 Pu. Debido a que convierte espontáneamente a 241 Am, 241 Pu puede ser extraído y puede ser utilizado para generar más 241 Am. Sin embargo, este proceso es bastante lento: la mitad de la cantidad original de 241 Pu decae a 241 Am después de unos 15 años, y la cantidad 241 Am alcanza un máximo después de 70 años.
El 241 Am obtenida se puede utilizar para generar más pesados isótopos de americio más por captura de neutrones en un reactor nuclear. En un reactor de agua ligera (LWR), el 79% de los 241 Am convierte a 242 Am y el 10% de su 242m isómero nuclear Am:
- 79%:
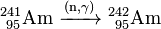
- 10%:
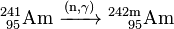
Americio-242 tiene una vida media de sólo 16 horas, lo que hace que su posterior conversión ascendente a 243 Am, extremadamente ineficiente. El último isótopo se produce en cambio, en un proceso en el 239 Pu captura cuatro neutrones bajo alto flujo de neutrones:
Generación de Metal
La mayoría de las rutinas de síntesis producir una mezcla de diferentes isótopos de actínidos en formas de óxido, de los cuales los isótopos de americio necesitan ser separados. En un procedimiento típico, el combustible gastado de los reactores (por ejemplo, Combustible MOX) se disuelve en ácido nítrico , y el grueso de uranio y el plutonio se elimina usando una Extracción de tipo PUREX (P lutonium - UR anium EX de tracción) con fosfato de tributilo en una hidrocarburos. Los lantánidos y actínidos restantes se separan entonces de el residuo acuoso ( refinado) por una a base de diamida de extracción, para dar, después de separación, una mezcla de actínidos y lantánidos trivalentes. Compuestos americio se extraen selectivamente usando varios pasos cromatográficos técnicas y centrifugación con un reactivo apropiado. Una gran cantidad de trabajo que se ha hecho sobre la extracción con disolvente del americio. Por ejemplo, un reciente UE proyecto financiado por el nombre en código "EUROPART" estudiado triazinas y otros compuestos como agentes de extracción potenciales. Bis complejo bipiridina -triazinyl Recientemente se ha propuesto como tal reactivo como altamente selectiva al americio (y el curio). Separación de americio desde el curio altamente similar puede conseguirse mediante el tratamiento de una suspensión de sus hidróxidos en solución acuosa de bicarbonato de sodio con ozono , a temperaturas elevadas. Tanto Am y Cm son en su mayoría presentes en soluciones en el estado 3 de valencia; mientras que el curio se mantiene sin cambios, el americio se oxida a soluble Am (IV) complejos que pueden ser arrastrados.
Americio metálico se obtiene por reducción de sus compuestos. El americio (III) de fluoruro fue utilizado primero para este propósito. La reacción se llevó a cabo utilizando elemental de bario como agente reductor en un entorno de agua y libre de oxígeno en el interior de un aparato hecho de tántalo y tungsteno .
Una alternativa es la reducción de dióxido de americio por metálico lantano o torio :
Propiedades físicas
En la tabla periódica , el americio se encuentra a la derecha del plutonio, a la izquierda de curio, y por debajo de la de los lantánidos europio , con el que comparte muchas similitudes en las propiedades físicas y químicas. Americio es un elemento altamente radiactivo. Cuando recién preparado, tiene un brillo metálico plateado-blanco, pero luego empaña lentamente en el aire. Con una densidad de 12 g / cm 3, americio es más ligero que tanto el curio (13,52 g / cm 3) y el plutonio (19,8 g / cm 3); pero es más pesado que el europio (5,264 g / cm 3) en su mayoría, debido a su masa atómica superior. Americio es relativamente blanda y fácilmente deformable y tiene una significativamente menor módulo de volumen de los actínidos ante sí: Th, Pa, U, Np y Pu. Su punto de fusión de 1.173 ° C es significativamente mayor que la de plutonio (639 ° C) y europio (826 ° C), pero menor que para el curio (1340 ° C).
En condiciones ambientales, el americio está presente en su forma más estable α que tiene una la simetría del cristal hexagonal, y una grupo espacial P6 3 / mmc con parámetros de red a = 346,8 pm y c = 1.124 horas, y cuatro átomos por celda unidad. El cristal se compone de una doble cerca hexagonal de embalaje con la secuencia de capas ABAC y así es isotípica con α-lantano y varios actínidos tales como α-curio. La estructura cristalina de americio cambia con la presión y la temperatura. Cuando se comprime a temperatura ambiente a 5 GPa, α-Am transforma a la modificación β, que tiene una cara cúbica centrada (norteamericana) de simetría, grupo espacial Fm 3 m y constante de red a = 489 pm. Esta estructura fcc es equivalente a la de embalaje más cercana con la secuencia ABC. Tras una posterior compresión de 23 GPa, americio transforma a una ortorrómbica estructura γ-Am similar a la de α-uranio. No hay más transiciones observadas hasta 52 GPa, a excepción de una aparición de una fase monoclínica a presiones entre 10 y 15 GPa. No hay consistencia en el estado de esta fase en la literatura, que a veces también se enumeran las fases α, β y γ como I, II y III. La transición β-γ se acompaña de una disminución del 6% en el volumen de cristal; Aunque la teoría también predice un cambio de volumen significativo para la transición α-β, no se observa experimentalmente. La presión de la transición α-β disminuye al aumentar la temperatura, y cuando α-americio se calienta a presión ambiente, a 770 ° C se transforma en una fase fcc que es diferente de β-Am, y en 1075 ° C se convierte en un centrada en el cuerpo estructura cúbica. El diagrama de fases de presión-temperatura del americio es por tanto bastante similares a los de lantano, praseodimio y neodimio .
Como con muchos otros actínidos, auto-daño de la red cristalina debido a la irradiación de partículas alfa es intrínseca al americio. Es especialmente notable a bajas temperaturas, donde la movilidad de la producida defectos en la red es relativamente bajo, ampliando de Picos de difracción de rayos-X. Este efecto hace que algo incierta la temperatura del americio y algunas de sus propiedades, como la electricidad resistividad. Así que para el americio-241, la resistividad en 4,2 K aumenta con el tiempo de aproximadamente 2 μOhm · cm a 10 μOhm · cm después de 40 horas, y se satura a unos 16 μOhm · cm después de 140 horas. Este efecto es menos pronunciado a temperatura ambiente, debido a la aniquilación de los defectos de radiación; También calentar a temperatura ambiente, la muestra, que se mantuvo durante horas a temperaturas bajas restaura su resistividad. En las muestras frescas, la resistividad aumenta gradualmente con la temperatura de alrededor de 2 cm en μOhm · helio líquido a 69 μOhm · cm a temperatura ambiente; Este comportamiento es similar a la de neptunio, uranio, torio y protactinio , pero es diferente de plutonio y el curio, que muestran un rápido aumento de hasta 60 K seguido por la saturación. El valor de la temperatura ambiente para el americio es menor que la de neptunio, plutonio y el curio, pero mayor que para el uranio, torio y protactinio.
Americio es paramagnético en un amplio rango de temperaturas, de la de helio líquido, a temperatura ambiente, y por encima. Este comportamiento es marcadamente diferente de la de su vecino curio que exhiben transición antiferromagnético a 52 K. La coeficiente de expansión térmica del americio es ligeramente anisotrópico y asciende a (7,5 ± 0,2) x 10 -6 / ° C a lo largo del más corto de un eje y (6,2 ± 0,4) x 10 -6 / ° C para el eje hexagonal ya c. La entalpía de disolución de americio de metal en ácido clorhídrico en condiciones estándar es -620,6 ± 1,3 kJ / mol, de la que el cambio estándar entalpía de formación (Δ f H °) de iones Am acuosa 3+ es -621,2 ± 2,0 kJ / mol -1. La Am potencial estándar 3+ / Am 0 es 2,08 ± 0,01 V.
Propiedades químicas
Americio reacciona fácilmente con el oxígeno y se disuelve bien en ácidos . El más común estado de oxidación para el americio es 3, en el que los compuestos americio son bastante estables contra la oxidación y reducción. En este sentido, el americio es químicamente similar a la mayoría de los lantánidos. Las formas americio trivalente insolubles fluoruro, oxalato, yodato, hidróxido , fosfato y otras sales. Otros estados de oxidación se han observado entre 2 y 7, que es la gama más amplia entre los elementos actínidos. Su color en soluciones acuosas varía de la siguiente manera: Am 3+ (incoloro a amarillo-rojizo), Am 4+ (amarillo-rojizo), Am V O +
2; (Amarillo), Am VI O 2 +
2 (marrón) y Am VII O 5-
6 (verde oscuro). Todos los estados de oxidación tienen sus espectros de absorción óptica característica, con unos picos agudos en las regiones visibles y el infrarrojo medio, y la posición y la intensidad de estos picos se pueden convertir en las concentraciones de los estados de oxidación correspondientes. Por ejemplo, Am (III) tiene dos picos agudos en 504 y 811 nm, Am (V) a 514 y 715 nm, y Am (VI) a 666 y 992 nm.
Compuestos americio con estado de oxidación +4 y superior son agentes oxidantes fuertes, comparable en fuerza a la ion permanganato (MnO -
4) en soluciones ácidas. Considerando que los iones Am 4+ son inestables en soluciones y fácilmente convertir a Am 3+, el estado de oxidación +4 se produce bien en sólidos, tales como dióxido de americio (AMO 2) y americio (IV) de fluoruro (AMF 4).
Todos pentavalente y hexavalente compuestos americio son sales complejas como Kamo 2 F 2, Li 3 AmO 4 y 6 Li AmO 6, Ba 3 AmO 6, AmO 2 F 2. Estos de alta oxidación declara Am (IV), Am (V) y Am (VI) puede prepararse a partir Am (III) por oxidación con persulfato de amonio en ácido nítrico diluido, con de plata (I) en óxido ácido perclórico, o con ozono o persulfato de sodio en soluciones de carbonato de sodio. El estado de oxidación pentavalente de americio se observó por primera vez en 1951. Está presente en solución acuosa en forma de AmO +
2 iones (ácido) o AmO -
3 iones (alcalino), que son sin embargo inestable y sujeto a varios rápida reacciones de desproporción:
Los compuestos químicos
Compuestos oxigenados
Dos óxidos americio se conocen, con los estados de oxidación 3 (Am 2 O 3) y 4 (AmO 2). El americio (III) de óxido es un sólido rojo-marrón con un punto de fusión de 2205 ° C. El americio (IV) óxido es la principal forma de americio sólido que se utiliza en casi todas sus aplicaciones. Como la mayoría de otros dióxidos de actínidos, es un sólido negro con un cúbico ( fluorita) estructura cristalina.
El oxalato de americio (III), se secó a temperatura ambiente al vacío, tiene la fórmula química Am 2 (C 2 O 4) 3 · 7H 2 O. Tras el calentamiento en vacío, pierde agua a 240 ° C y comienza a descomponerse en AmO 2 a 300 ° C, la descomposición completa en alrededor de 470 ° C. El oxalato inicial se disuelve en ácido nítrico con la solubilidad máxima de 0,25 g / L.
Haluros
Haluros de americio son conocidos por los estados de oxidación +2, +3 y +4, donde el 3 es el más estable, especialmente en soluciones.
| Estado de oxidación | F | Cl | Br | YO |
|---|---|---|---|---|
| 4 | Americio (IV) de fluoruro AmF 4 rosa palido | |||
| 3 | Americio (III) de fluoruro AmF 3 rosa | Americio cloruro (III) AMCL 3 rosa | El americio (III) bromuro de AMBR 3 amarillo claro | El americio (III) de yoduro de AmI 3 amarillo claro |
| 2 | El americio (II) cloruro de AMCL 2 negro | El americio (II) bromuro de AMBR 2 negro | El americio (II) de yoduro de AmI 2 negro |
Reducción de Am (III) compuestos con sodio amalgama produce Am (II) sales - los haluros negras AMCL 2, AMBR 2 y el IAM 2. Son muy sensibles al oxígeno y se oxidan en agua, liberando hidrógeno y convertir de nuevo al estado Am (III). Constantes específicas de celosía son:
- Ortorrómbico AMCL 2: a = 896,3 ± 0,8 h, b = 757,3 ± 0,8 pm y c = 453,2 ± 24:06
- Tetragonal AMBR 2: a = 1159,2 ± 0,4 y c = 712,1 ± 0,3 h.
También se pueden preparar por reacción de americio metálico con un haluro de mercurio apropiada HgX 2, donde X = Cl, Br o I:
Americio (III) de fluoruro (AMF 3) es poco soluble y precipita tras la reacción de Am 3+ y los iones de fluoruro en soluciones ácidas débiles:
El americio tetravalente (IV) de fluoruro (AMF 4) se obtiene haciendo reaccionar el americio sólido (III) con fluoruro molecular de flúor :
Otra forma conocida de cloruro de americio tetravalente sólido es KAmF 5. Americio tetravalente también se ha observado en la fase acuosa. Para este propósito, negro Am (OH) 4 se disolvió en 15 M NH 3 F con la concentración americio de 0,01 M. La solución rojiza resultante tenía un espectro de absorción óptica característica que es similar a la de AmF 4 pero diferían de otros estados de oxidación de americio. El calentamiento de la solución Am (IV) a 90 ° C no resultó en su desproporción o reducción, sin embargo se observó una reducción lenta de Am (III) y se asigna a la auto-irradiación de americio por partículas alfa.
La mayoría americio (III) haluros forman cristales hexagonales con ligera variación del color y la estructura exacta entre los halógenos. Así, cloruro de (AMCL 3) es de color rojizo y tiene una estructura isotípico uranio (III) cloruro (grupo espacial P6 3 / m) y el punto de fusión de 715 ° C. El fluoruro es isotípico LaF3 (grupo espacial P6 3 / mmc) y el yoduro de Bii 3 (espacio grupo R3). El bromuro es una excepción con el ortorrómbica PuBr 3 de tipo estructura y espacio grupo Cmcm. Los cristales de hexahidrato de americio (AMCL 3 · 6H 2 O) se pueden preparar mediante la disolución de dióxido de americio en ácido clorhídrico y evaporar el líquido. Dichos cristales son higroscópicos y tienen color amarillo-rojizo y una estructura cristalina monoclínica.
Oxihaluros de americio en forma Am VI O 2 X 2, Am V O 2 X, Am IV OX 2 y Am III OX se pueden obtener haciendo reaccionar el correspondiente haluro americio con oxígeno o Sb 2 O 3, y AmOCl también se pueden producir por fase de vapor hidrólisis:
Calcogenuros y pníctidos
La conocida calcogenuros de americio incluyen la AmS sulfuro 2, seleniuros AMSE 2 y Am 3 SE 4, y telururos Am 2 Te 3 y Amte 2. La pníctidos de americio (Am 243) del tipo AMX son conocidos por los elementos fósforo , arsénico , antimonio y bismuto . Se cristalizan en el celosía de sal gema.
Siliciuros y boruros
Americio monosilicide (AARMI) y "disiliciuro" (nominalmente Amsi x con: 1,87 <x <2,0) se obtuvieron por reducción de americio (III) con fluoruro elemental de silicio en el vacío a 1050 ° C (AARMI) y 1250/00 ° C (AARMI x). Amsi es un sólido isomorfo negro con Lasi, tiene una simetría cristalina ortorrómbica. Amsi x tiene un lustre plateado brillante y una red cristalina tetragonal (grupo espacial I 4 1 / AMD), es isomorfo con pusi 2 y THSI 2. Boruros de americio incluyen Amb 4 y 6 Amb. El tetraboruro puede obtenerse por calentamiento de un óxido o haluro de americio con diboruro de magnesio en vacío o en atmósfera inerte.
Compuestos Organoamericium
Análogo a uranocene, americio forma un compuesto organometálico con dos ligandos ciclooctatetraeno, que es (η 8 -C 8 H 8) 2 am. También hace trigonal (η 5 -C 5 H 5) 3 complejos estoy con tres anillos de ciclopentadienilo.
La formación de los complejos del tipo Am (nC 3 H 7 -BTP) 3, donde BTP significa 2,6-di (1,2,4-triazin-3-il) piridina, en soluciones que contienen nC 3 H 7 - iones BTP y Am 3+ ha sido confirmada por EXAFS. Algunos de estos complejos de tipo BTP interactúan selectivamente con americio y por lo tanto son útiles en su separación selectiva de lantánidos y actínidos otros.
Aspectos biológicos
Americio es un elemento artificial, y por lo tanto una función biológica involucra al elemento, como todos los elementos más pesados que el tungsteno , sería imposible. Se ha propuesto el uso de bacterias para la eliminación de americio y otros metales pesados de los ríos y arroyos. Por lo tanto, Enterobacterias del género Citrobacter precipitar iones americio partir de soluciones acuosas, uniéndolos en un complejo de metal-fosfato a sus paredes celulares. Varios estudios han reportado en la biosorción y bioacumulación de americio por bacterias y hongos.
Fisión
El isótopo Am 242m1 (vida media de 141 años) tiene las secciones transversales más grandes para la absorción de neutrones térmicos (5700 graneros), que se traduce en una pequeña masa crítica para un sostenido reacción nuclear en cadena. La masa crítica para un desnudo esfera 242m1 Am es de unos 9-14 kg (los resultados de incertidumbre de un conocimiento insuficiente de las propiedades de los materiales). Se puede baja a 3-5 kg con un reflector de metal y debe convertirse en incluso más pequeño con un reflector agua. Esa pequeña masa crítica es favorable para portátiles armas nucleares , pero los basados en 242m1 Am no se conocen todavía, probablemente debido a su escasez y alto precio. Las masas críticas de otros dos isótopos fácilmente disponibles, 241 Am y 243 Am, son relativamente altos - 57,6 a 75,6 kg para 241 Am y 209 kg para 243 Am. La escasez y el alto precio aún obstaculizan la aplicación de americio como combustible nuclear en reactores nucleares.
Hay propuestas de muy compactas de 10 kW reactores de alto flujo utilizando tan sólo 20 gramos de 242m1 Am. Tales reactores de baja potencia sería relativamente seguro para su uso como fuentes de neutrones para radioterapia en los hospitales.
Isótopos
Sobre 19 isótopos y 8 isómeros nucleares son conocidos por el americio. Hay dos emisores alfa de vida larga, 241 Am y 243 Am con vidas medias de 432,2 y 7.370 años, respectivamente, y el 242m1 isómero nuclear Am tiene una larga vida media de 141 años. Las vidas medias de otros isótopos e isómeros van desde 0,64 microsegundos para 245m1 Am 50.8 horas para 240 Am. Como con la mayoría de otros actínidos, los isótopos de americio con número impar de neutrones tienen relativamente alta tasa de fisión nuclear y baja masa crítica.
Americio-241 decae a 237 Np partículas que emiten alfa de 5 energías diferentes, sobre todo en 5,486 MeV (85,2%) y 5.443 MeV (12,8%). Debido a que muchos de los estados resultantes son metaestable, también emiten rayos gamma con energías discretas entre 26,3 y 158,5 keV.
Americio-242 es un isótopo de vida corta con una vida media de 16,02 h. En su mayoría (82,7%) convierte por β-decaimiento a 242 Cm, sino también por captura de electrones a 242 Pu (17,3%). Tanto 242 Cm y 242 Pu transformar a través de casi la misma cadena de desintegración a través de 238 Pu hasta 234 U.
Casi todos (99,541%) de 242m1 Am desintegra conversión interna a 242 Am y el 0,459% restante por α-decadencia a 238 Np. Este último se desglosa en 238 Pu y luego a 234 U.
Americio-243 transformadas por α-emisión a 239 Np, que convierte por β-decadencia a 239 Pu, y el 239 Pu se transforma en 235 U por emisión de una partícula α.
Aplicaciones
Detectores de ionización
Americio es el único elemento sintético de haber encontrado su camino en el hogar, donde un tipo común de detector de humo tiene 241 Am en forma de dióxido de americio como fuente de radiación ionizante. Se prefiere este isótopo contra 226 Ra porque emite 5 veces más partículas alfa y relativamente poco de γ-radiación dañina. La cantidad de americio en un nuevo detector de humo típico es 1 microcurie (37 kBq) o 0,28 microgramos. Esta cantidad disminuye lentamente a medida que el americio se desintegra en el neptunio -237, un elemento transuránicos diferente, con una vida media mucho más larga (alrededor de 2,14 millones años). Con su vida media de 432,2 años, el americio en un detector de humo incluye aproximadamente 3% de neptunio después de 19 años, y aproximadamente 5% después de 32 años. La radiación pasa a través de una cámara de ionización, un espacio lleno de aire entre dos electrodos, y los permisos de un pequeño, constantes corriente entre los electrodos. Cualquier humo que entra en la cámara absorbe las partículas alfa, lo que reduce la ionización y afecta a esta corriente, lo que provocó la alarma. En comparación con el detector de humo óptico alternativa, el detector de humo de ionización es más barato y puede detectar partículas que son demasiado pequeñas para producir significativa dispersión de la luz; sin embargo, es más propenso a falsas alarmas.
Radionúclidos
Como Am 241 tiene una vida media significativamente más larga que 238 Pu (432,2 años vs. 87 años), se ha propuesto como un elemento activo de generadores termoeléctricos de radioisótopos, por ejemplo en las naves espaciales. Aunque americio produce menos calor y electricidad - el rendimiento de potencia es 114,7 mW / g para 241 Am y 6,31 mW / g para 243 Am (cf. 390 mW / g para 238 Pu) - y su radiación representa más peligro para los seres humanos debido a neutrones emisión, la Agencia Espacial Europea está planeando utilizar el americio por sus sondas espaciales.
Otra aplicación relacionada con el espacio propuesto de americio es un combustible para naves espaciales con propulsión nuclear. Se basa en la muy alta tasa de fisión nuclear de 242m Am, que puede mantenerse incluso en una lámina de micrómetros de espesor. Pequeño espesor evita el problema de la auto-absorción de la radiación emitida. Este problema es pertinente uranio o plutonio varillas, en el que sólo las capas superficiales proporcionan partículas alfa. Los productos de fisión de 242m Am pueden ya sea directamente propulsar la nave espacial o pueden calentar un gas de empuje; sino que también puede transferir su energía a un fluido y generar electricidad a través de un generador magnetohidrodinámica.
Una de las propuestas más que utiliza la tasa de fisión nuclear alto de 242m Am es una batería nuclear. Su diseño no se basa en la energía de la emitida por las partículas alfa americio, pero en su carga, es decir, los actos americio como el "cátodo" auto-sostenible. Un solo 3,2 kg de carga Am 242m de dicha batería podría proporcionar aproximadamente 140 kW de potencia durante un período de 80 días.Con todos los beneficios potenciales, las aplicaciones actuales de242mAm están todavía tan obstaculizados por la escasez y el alto precio de este isómero nuclear.
Producción de otros elementos
Americio es un material de partida para la producción de otros elementos transuránicos y transactinides - por ejemplo, el 82,7% de 242 Am decae a 242 Cm y el 17,3% a 242 Pu. En el reactor nuclear, 242 Am es también convertidas por captura de neutrones de 243 Am y 244 Am, que transforma por β-decadencia de 244 Cm:
La irradiación de 241 Am por 12 C o 22 iones Ne produce los isótopos 247 de Es ( einsteinio ) o 260 Db ( dubnium ), respectivamente. Además, el elemento berkelio ( 243 Bk isótopos) se había producido e identificado mediante el bombardeo de primera intencionadamente 241 Am con partículas alfa, en 1949, por el mismo grupo de Berkeley, utilizando el mismo ciclotrón de 60 pulgadas. Del mismo modo, nobelio fue producido en el Instituto Conjunto para la Investigación Nuclear, Dubna, Rusia, en 1965 en varias reacciones, uno de los cuales incluían la irradiación de 243 Am con 15 iones N. Además, una de las reacciones de síntesis para lawrencium , descubiertos por científicos de Berkeley y Dubna, incluido el bombardeo de 243 Am con 18 O.
Espectrómetro
Americio-241 se ha utilizado como una fuente portátil de ambos rayos gamma y las partículas alfa para un número de usos médicos e industriales. Las emisiones gamma rayos-60 keV de 241 Am en tales fuentes pueden ser utilizados para el análisis indirecto de los materiales en la radiografía y la espectroscopia de fluorescencia de rayos X, así como para el control de calidad en fijos medidores de densidad nuclear y densometers nucleares. Por ejemplo, el elemento se ha empleado para medir vidrio espesor para ayudar a crear vidrio plano. Americio-241 también es adecuado para la calibración de los espectrómetros de rayos gamma en el rango de baja energía, ya que su espectro consta de casi un pico simple y continuo Compton insignificante (al menos tres órdenes de magnitud menor intensidad). Rayos gamma americio-241 también se utilizaron para proporcionar diagnóstico pasiva de la función tiroidea. Esta aplicación médica es sin embargo obsoleto.
Problemas de salud
Como un elemento altamente radiactivo, americio y sus compuestos tienen que ser manejados solamente en un laboratorio adecuado en virtud de acuerdos especiales. Aunque la mayoría de los isótopos de americio emiten predominantemente partículas alfa que puede ser bloqueado por capas delgadas de materiales comunes, muchos de los productos hija emiten rayos gamma y los neutrones que tienen una profundidad de penetración de largo.
Si se consume, americio se excreta dentro de unos pocos días y sólo 0,05% se absorbe en la sangre. A partir de ahí, más o menos 45% de los que va a la de hígado y 45% a los huesos, y el 10% restante se excreta. La captación en el hígado depende de la persona y aumenta con la edad. En los huesos, americio se deposita primero sobre corticales y superficies trabeculares y lentamente redistribuye sobre el hueso con el tiempo. La vida media biológica de 241 Am es de 50 años en los huesos y los 20 años en el hígado, mientras que en las gónadas (testículos y ovarios) que se mantiene en forma permanente; en todos estos órganos, americio promueve la formación de células cancerosas como resultado de su radiactividad.
Americio menudo entra en vertederos de descartados detectores de humo. Las reglas asociadas con la eliminación de los detectores de humo están relajados en la mayoría de las jurisdicciones. En los EE.UU., el "Radioactive Boy Scout" David Hahn era capaz de concentrarse americio de los detectores de humo después de la gestión de comprar un centenar de ellos a precios restantes y también el robo de unos pocos. Se han dado casos de personas que se contaminan con el americio, el peor de los casos siendo la de Harold McCluskey, quien a la edad de 64 fue expuesto a 500 veces el nivel ocupacional de americio-241 como consecuencia de una explosión en su laboratorio. McCluskey murió a la edad de 75, no como resultado de la exposición, sino de una enfermedad del corazón que tenía antes del accidente.
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {(n, \ gamma)} \ ^ {240} _ {\ 94} Pu \ \ xrightarrow {(n, \ gamma)} \ ^ {241 } _ {\ 94} Pu \ \ xrightarrow [14,35 \ año] {\ beta ^ -} \ ^ {241} _ {\ 95} Am \ \ left (\ \ xrightarrow [432,2 \ año] {\ alpha} \ ^ {237} _ {\ 93} Np \ right)}](../../images/1281/128125.png)
![\ Mathrm {^ {241} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {242} _ {\ 95} Am \ \ left (\ \ xrightarrow [16,02 \ h] {\ beta ^ -} \ ^ {242} _ {\ 96} Cm \ right)}](../../images/1281/128126.png)
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow {(n, \ gamma)} \ ^ {239} _ {\ 92} U \ \ xrightarrow [23,5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94} Pu}](../../images/1281/128135.png)
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {2 (n, \ gamma)} \ ^ {241} _ {\ 94} Pu \ \ xrightarrow [14,35 \ año] {\ beta ^ -} \ ^ {241} _ {\ 95} Am}](../../images/1281/128136.png)
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {4 (n, \ gamma)} \ ^ {243} _ {\ 94} Pu \ \ xrightarrow [4,956 \ h] {\ beta ^ -} \ ^ {243} _ {\ 95} Am}](../../images/1281/128139.png)
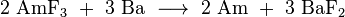
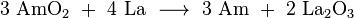
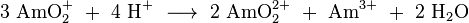

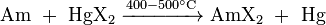

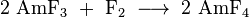



![\mathrm{^{243}_{\ 95}Am\ \xrightarrow {(n,\gamma)} \ ^{244}_{\ 95}Am\ \xrightarrow [10.1 \ h]{\beta^-} \ ^{244}_{\ 96}Cm}](../../images/1281/128167.png)
