
Ozônio
Sobre este escolas selecção Wikipedia
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Ozônio | |
|---|---|
 | |
 | |
 | |
Trioxygen | |
| Identificadores | |
| Número CAS | 10028-15-6 |
| Propriedades | |
| Fórmula molecular | O 3 |
| Massa molar | 47,998 g · mol -1 |
| Aparência | gás de cor azulada |
| Densidade | 2,144 g · L-1 (0 ° C), o gás |
| Ponto de fusão | 80,7 K, -192,5 ° C |
| Ponto de ebulição | 161,3 K, -111,9 ° C |
| Solubilidade em água | 0,105 g · 100 mL -1 (0 ° C) |
| Termoquímica | |
| Entalpia padrão de formação Δ f H | 142,3 kJ mol -1 · |
| Molar padrão entropia S | 237,7 J · K -1 .mol -1 |
| Perigos | |
| Classificação da UE | não listado |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
O ozono (O3) é um triatômica molécula , que consiste em três oxigénio átomos . É um alótropo de oxigénio que é muito menos estável do que o diatómico O 2. O ozono troposférico é um poluente do ar com efeitos nocivos sobre o sistema respiratório de animais. O ozônio na atmosfera superior filtros potencialmente prejudiciais luz ultravioleta que atinge a superfície da Terra. Ela está presente em baixas concentrações em todo o atmosfera da Terra . Tem muitas aplicações industriais e de consumo. O ozono, o primeiro alótropo de um elemento químico a ser reconhecida pela ciência, foi proposto como um composto químico distinto por Christian Friedrich Schönbein em 1840, que nomeou-o após o grego palavra para cheiro (ozein), a partir do odor peculiar em a ocorrência de trovoadas. A fórmula para ozônio, O 3, não foi determinada até 1865 por Jacques-Louis Soret e confirmado por Schönbein em 1867. O odor de um raio é de íons produzidos durante as mudanças químicas rápidas, não a partir do próprio ozônio.
Propriedades físicas
O ozônio é um azul, gás venenoso pálido com um afiado, frio, odor irritante. A maioria das pessoas pode detectar cerca de 0,01 ppm no ar. A exposição a 0,1 a 1 ppm produz dores de cabeça, olhos ardentes e irritação das vias respiratórias.
No -112 ° C, forma-se um azul escuro líquido . A temperaturas inferiores a -193 ° C, forma-se um negro-violeta sólido .
Estrutura
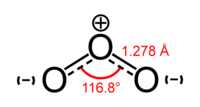
A estrutura de ozônio, de acordo com a evidência experimental de espectroscopia de microondas, é dobrado, com C 2v simetria (semelhante à água molécula), O - O raio de 127,2 pm e O - O - O ângulo de 116,78 °. O átomo central forma um ² hibridação sp com um par solitário. O ozono é uma molécula polar com um momento de dipolo de 0,5337 D. A ligação é ligação simples de um lado e dupla ligação, por outro lado, e estas ligações são misturados para se tornar conhecido como estruturas de ressonância. O ordem de ligação é de 1,5 para cada lado.
Química
O ozônio é um poderoso agente oxidante, muito melhor do que dioxygen. Também é instável a concentrações elevadas, a decomposição de oxigénio diatómico ordinário (em cerca de meia hora em condições atmosféricas):
- 2 O 3 → 3 O 2.
Esta reacção processa-se mais rapidamente com o aumento de temperatura e a diminuição da pressão. Deflagração de ozono pode ser desencadeada por uma faísca, e pode ocorrer em concentrações de ozono de 10% em peso ou superior. O ozono oxida metais (com excepção do ouro , platina e irídio ) para óxidos dos metais no seu mais elevado estado de oxidação :
- Cu2 + 2 (aq) + 2 H 3 O + (aq) + O 3 (g) → 2 Cu 3+ (aq) + 3 H2O (l) + O 2 (g)
O ozono também aumenta o número de oxidação de óxidos:
- NO + O 3 → NO 2 + O 2
A reacção acima é acompanhada pela quimioluminescência. O NO 2 pode ser ainda mais oxidado:
- NO 2 + O 3 → NO 3 + O 2
O NO 3 formado pode reagir com NO 2 para formar N 2 O 5:
- NO2 + NO3 → N 2 O 5
O ozono reage com o carbono para formar o dióxido de carbono , mesmo à temperatura ambiente:
- C + 2 O 3 → CO2 + H2O 2
O ozônio não reage com amónio sais mas reage com amónia para formar nitrato de amónio:
- 2 NH 3 + 4 O 3 → NH 4 NO 3 + 4 O 2 + H 2 O
O ozono reage com sulfetos para fazer sulfatos :
- PBS + 4 O 3 → PBSO 4 + 4 O 2
Ácido sulfúrico pode ser produzido a partir de ozono, a partir quer da elementar de enxofre ou de dióxido de enxofre:
- S + H 2 O + O 3 → H 2 SO 4
- 3 SO 2 + 3 H 2 O + O 3 → 3 H 2 SO 4
Todos os três átomos de ozono pode também reagir, tal como na reacção com estanho (II) e cloreto de ácido clorídrico e de NaCl, juntamente com nitrato de amónio:
- 3 SnCl 2 HCl + 6 + O 3 → 3 SnCl 4 + 3 H2O
Na fase gasosa , o ozono reage com sulfeto de hidrogênio para formar dióxido de enxofre:
- H 2 S + O 3 → SO2 + H2O
Numa solução aquosa, no entanto, duas reacções simultâneas concorrentes ocorrer, uma para produzir enxofre elementar, e um para produzir ácido sulfúrico:
- H 2 S + O 3 → S + O2 + H2O
- 3 H 2 S + O 3 4 → 3 H 2 SO 4
Iodo perclorato pode ser feito por tratamento de iodo dissolvido em frio anidro ácido perclórico com o ozônio:
- I 2 + 6 HClO 4 + O 2 3 → I (ClO 4) 3 + 3 H2O
Sólido perclorato de nitrilo pode ser feita a partir de NO 2, ClO 2, 3 e ó gases:
- 2 NO2 + 2 ClO 2 + 2 O 3 → 2 NO 2 ClO 4 + O2
O ozono pode ser utilizado para reacções de combustão e os gases de combustão de ozono fornece em temperaturas mais elevadas do que a combustão nas dioxigénio (O2). Segue-se uma reacção para a combustão de subnitride de carbono, que também pode causar temperaturas mais baixas:
- 3 C 4 N 2 O 3 + 4 → 12 CO + 3 N 2
O ozônio pode reagir em temperaturas criogênicas. A 77 K (-196 ° C), atómica de hidrogénio reage com o ozono líquido para formar um hidrogénio superóxido radical, que dimeriza:
- H + O 3 → HO 2 + O
- 2 HO → 2 H 2 O 4
Ozonídeos podem ser formados, os quais contêm o ânion ozonide, O 3 -. Estes compostos são explosivas e devem ser armazenados em temperaturas criogênicas. Ozonídeos para todos os metais alcalinos são conhecidos. KO 3, RBO 3, CSO e 3 pode ser preparado a partir de seus respectivos superóxidos:
- KO 2 + O 3 → KO 3 + O 2
Embora KO 3 pode ser formado como acima, também pode ser formado a partir de hidróxido de potássio e de ozono:
- 2 KOH + 5 O 3 → 2 KO 3 + 5 O 2 + H 2 O
NaO 3 e LiO 3 deve ser preparado por ação de CSO 3 em NH3 líquido em um resina de permuta iónica contendo iões Na + ou Li +:
- CSO 3 + Na + → Cs + + NaO 3
Tratamento com ozono de cálcio dissolvido em amónia conduz à amónio ozonido ozoneto e não de cálcio:
- 3 Ca + NH3 + 10 6 O 3 → Ca • 6NH 3 + Ca (OH) 2 + Ca (NO3) 2 + 2NH 4 O 3 + 2 + H 2 O 2
O ozono pode ser utilizado para remover o manganês da água , formando um precipitado que pode ser filtrado:
- Mn2 + 2 + 2 O 3 + 4 H2O → MnO 2 (OH) 2 (s) + 2 O2 + 4H +
O ozônio também vai virar cianetos aos mil vezes menos tóxicos cianatos:
- CN - + O 3 → CNO - + O 2
Finalmente, o ozono também irá decompor completamente a ureia :
- (NH 2) 2 + O CO 3 → N 2 + CO 2 + 2 H2O
O ozônio na atmosfera da Terra



A forma padrão para expressar níveis totais de ozono (o volume de ozono em uma coluna vertical) na atmosfera é através da utilização Unidades Dobson. Concentrações em um ponto são medidas em partes por bilhão (ppb) ou em mg / m³.
Camada de ozônio
Os mais altos níveis de ozônio na atmosfera estão no estratosfera, numa região, também conhecido como o camada de ozônio entre cerca de 10 km e 50 km acima da superfície (ou entre 6,21 e 31,1 milhas). Aqui ele filtra fótons com comprimentos de onda mais curtos (menos de 320 nm) de ultravioleta luz, também chamados de raios UV, (270 a 400 nm) da Sun que seriam prejudiciais para a maioria das formas de vida em grandes doses. Estes mesmos comprimentos de onda também estão entre os responsáveis para a produção de vitamina D , o que é essencial para a saúde humana . Ozono na estratosfera é principalmente produzido a partir de raios ultravioletas reagem com o oxigênio:
- O 2 + fótons (radiação <240 nm) → 2 O
- O + O 2 O 3 →
Ele é destruído por reacção com oxigênio atômico:
- O 3 + O → 2 O 2
(Ver Ciclo de ozônio em oxigênio para mais detalhes.)
A última reacção é catalisada pela presença de certos radicais livres, dos quais os mais importantes são hidroxilo (OH), óxido nítrico (NO) e de cloro atómica (Cl) e bromo (Br). Nas últimas décadas, a quantidade de ozono na estratosfera tem vindo a diminuir, principalmente devido às emissões de CFCs e moléculas orgânicos clorados e bromados semelhantes, que aumentaram a concentração de catalisadores que destroem o ozono acima do fundo natural. Ozone só faz-se 0,00006% da atmosfera. Veja destruição do ozônio para mais informações.
Baixo nível de ozônio
Baixo nível de ozônio (ou ozono troposférico) é considerada como um poluente pela Organização Mundial de Saúde . Não é emitida directamente pela motores de automóveis ou por operações industriais. Ele é formado pela reacção da luz solar sobre o ar que contém hidrocarbonetos e óxidos de nitrogênio que reagem para formar o ozônio diretamente na fonte da poluição ou muitos quilômetros na direção do vento. Para mais detalhes sobre as complexas reações químicas que produzem baixos níveis de ozônio ver ozono troposférico.
O ozono reage directamente com alguns hidrocarbonetos tais como aldeídos e começa assim a sua remoção do ar, mas os produtos são eles mesmos componentes-chave da poluição atmosférica . Ozônio fotólise por luz UV conduz à produção do radical hidroxilo OH e este desempenha um papel na remoção de hidrocarbonetos a partir do ar, mas é também o primeiro passo na criação de componentes de poluição atmosférica, tais como peroxyacyl nitratos que podem ser irritantes para os olhos poderosos. O tempo de vida atmosférica de ozono troposférico é de cerca de 22 dias e os seus principais mecanismos de remoção estão a ser depositado no chão, a reacção acima mencionada dando OH, e por reacções com OH e o peroxi radical HO 2 · (Stevenson et ai, 2006).
Bem como ter um impacto sobre a saúde humana (ver abaixo), há também evidência de redução significativa na produtividade agrícola, devido ao aumento de ozono ao nível do solo e poluição que interfere com fotossíntese e prejudica o crescimento global de algumas espécies vegetais.
Alguns exemplos de cidades com leituras elevadas de ozono são Houston e Cidade do México. Houston tem uma leitura de cerca de 41 ppb, enquanto a Cidade do México é muito mais perigoso, com uma leitura de cerca de 125 ppb.
Ozono, um gás com efeito de estufa
Embora o ozônio esteve presente ao nível do solo antes da revolução industrial , as concentrações máximas foram muito mais elevados do que os níveis pré-industriais e até mesmo concentrações de fundo bem longe de fontes de poluição são substancialmente mais elevados. Este aumento de ozono é outra preocupação como o ozônio presente na parte superior troposfera atua como um gás de efeito estufa , absorvendo um pouco do a energia infravermelha emitida pela terra. Quantificar a potência de gás com efeito de estufa de ozônio é difícil uma vez que não está presente em concentrações uniformes em todo o mundo. No entanto, a avaliação científica mais recente sobre a mudança climática (o IPCC Terceiro Relatório de Avaliação) sugere que o forçamento radiativo de ozono troposférico é cerca de 25% do que o dióxido de carbono .
Ozone craqueamento
Ataques com gás ozônio nenhum polímero olefínico ou possuindo ligações duplas dentro de sua estrutura de cadeia, incluindo esses materiais de borracha natural , borracha nitrílica, e Borracha de estireno-butadieno. Os produtos feitos com estes polímeros são especialmente susceptíveis para o problema, o que provoca fissuras profundas e perigosas para crescer lentamente com o tempo, a taxa de crescimento da fissura, dependendo da carga transportada pelo produto e a concentração de ozono na atmosfera. Tais produtos podem ser protegido por adição de anti-ozonants, tais como ceras, que florescem na superfície e criar uma película de protecção. Rachaduras ozono costumava ser um problema grave em pneus de carros, por exemplo, mas o problema agora é visto apenas em pneus muito velhos.
Ozônio e saúde
O ozônio na poluição do ar
Há uma grande quantidade de evidências que mostram que altas concentrações (ppm) de ozono, criados por altas concentrações de poluição ea luz do dia os raios UV à superfície da terra, pode prejudicar a função pulmonar e irritar a sistema respiratório. A conexão também tem sido demonstrado que existe entre o aumento do ozono causadas por tempestades e internações hospitalares de asma sofredores. Diretrizes de qualidade do ar, tais como os da Organização Mundial da Saúde são baseados em estudos detalhados sobre o que pode causar níveis mensuráveis efeitos para a saúde.
Um mito popular britânica comum que remonta à era vitoriana sustenta que o cheiro do mar é causada pelo ozono, e que isso tem cheiro "órtese" benefícios para a saúde. Nenhuma delas é verdadeira. O "cheiro do mar" característica não é causado pelo ozono, mas pela presença de sulfureto de dimetilo gerado pela fitoplâncton, e dimetil sulfeto, como o ozônio, é tóxico em altas concentrações.
O Agência de Proteção Ambiental dos Estados Unidos desenvolveu um índice de qualidade do ar para ajudar a explicar os níveis de poluição do ar para o público em geral. 8 horas concentrações médias de ozono de 85-104 ppbv são descritos como "insalubre para grupos sensíveis", 105 ppbv a 124 ppbv como "insalubre" e 125 ppb para 404 ppb como "muito saudável". A EPA designou mais de 300 municípios dos Estados Unidos, agrupados em torno das mais populosas áreas (especialmente na Califórnia e no Nordeste), como a falta de cumprimento da Padrões de Qualidade nacionais do ar ambiente.
O ozono pode também estar presente em poluição do ar interior.
Fisiologia do ozono
Ozono, juntamente com formas reactivas de oxigénio, tal como superóxido, oxigénio atómico (veja oxigênio ), peróxido de hidrogênio , e iões de hipoclorito, é produzida naturalmente pela células brancas do sangue e outros sistemas biológicos (tais como as raízes de malmequeres) como um meio de destruir corpos estranhos. O ozônio reage diretamente com duplas ligações orgânicas. Além disso, quando o ozono se decompõe em dioxigénio dá origem a oxigénio Os radicais livres, que são altamente reactivos e capaz de danificar muitas moléculas orgânicas . O ozono tem sido encontrado para converter colesterol na corrente sanguínea a placa (o que provoca o endurecimento e estreitamento das artérias). Além disso, acredita-se que as propriedades oxidantes poderosos de ozono pode ser um factor que contribui de inflamação. A relação de causa e efeito de como o ozônio é criado no corpo eo que ele faz ainda sob consideração e ainda está sujeita a várias interpretações, uma vez que outros processos químicos do corpo pode provocar algumas das mesmas reações. A equipe chefiada pelo Dr. Paul Wentworth Jr., do Departamento de Química da Scripps Research Institute mostrou evidência ligando a água-oxidação catalisada por via do anticorpo humano resposta imunitária para a produção de ozono. Neste sistema, o ozono é produzido por uma produção catalisada por anticorpo de trioxidane de água e de neutrófilos-produzido oxigénio atómico. Veja também trioxidane para saber mais sobre esta reacção de produção de ozônio biológica.
O ozônio também tem sido comprovada para formar específico, metabólitos derivados do colesterol que são pensados para facilitar a acumulação e patogênese de placas ateroscleróticas (uma forma de doença cardíaca). Estes metabolitos foram confirmados como ocorre naturalmente em artérias ateroscleróticas humanas e são classificados em uma classe de secosterols denominado "ateronais", gerado por ozonólise de ligação dupla de colesterol para formar um 5,6 secosterol, bem como um produto de condensação secundária através aldolização.
O ozono tem sido implicada a ter um efeito adverso no crescimento das plantas, "... de ozono reduzida clorofilas, carotenóides e concentração total de hidratos de carbono, e aumento do ácido 1-aminociclopropano-1-carboxílico (ACC) e o conteúdo de produção de etileno. Em plantas tratadas, o piscina folha ascorbato foi diminuída, enquanto a peroxidação lipídica e vazamento soluto foram significativamente maiores do que nos controles sem ozônio. Os dados indicaram que o ozônio desencadeado mecanismos de protecção contra o estresse oxidativo em citros. "
A utilização de ozono no tratamento médico
O papel fisiológico recentemente descoberto de ozono levou ozono defensores médicas para sugerir como um mecanismo para a utilização de ozono produzido artificialmente para matar micróbios no sangue. Ozono inalado é tóxico para o tecido pulmonar em pequenas quantidades, mas ozono parece ser menos tóxico quando directamente misturado com o sangue, no interior ou no exterior do corpo. No entanto, a utilidade de ozono no tratamento médico (se houver) é um assunto de debate. Nenhuma forma de terapia de ozono está actualmente aprovado pela FDA em os EUA
Preparação
Ozono forma frequentemente na natureza sob condições em que O 2 não irá reagir. Ozone utilizado na indústria é medida em g / Nm³ ou por cento em peso. O regime de concentrações aplicadas varia de 1 a 5 por cento em peso de ar e de 6 a 13 por cento em peso de oxigénio .
Método de descarga Corona
Este é o mais popular tipo de gerador de ozônio para a maioria dos usos industriais e pessoais. Embora as variações da "faísca quente" método de descarga coronal de produção de ozono não existem, incluindo geradores de grau médico e ozono de grau industrial, essas unidades funcionam normalmente por meio de um tubo de descarga corona. Eles são tipicamente muito eficaz em termos de custos, e não necessitam de uma fonte de oxigénio que não seja o ar ambiente. No entanto, eles também produzem óxidos de azoto como um subproduto. Uso de um Secador de ar pode reduzir ou eliminar a formação de ácido nítrico por remoção de vapor de água e aumentar a produção de ozono. Uso de um concentrador de oxigénio pode aumentar ainda mais a produção de ozono e reduzir ainda mais o risco de formação de ácido nítrico devido à remoção de não apenas o vapor de água, mas também a maior parte do azoto.
A luz ultravioleta
Geradores de ozônio UV empregar uma fonte de luz que gera o mesmo de banda estreita ultravioleta luz que é responsável pelo sustento da camada de ozônio na estratosfera da Terra. Embora os geradores de ozono UV padrão tendem a ser menos caros, eles geralmente produzem ozono com uma concentração de cerca de 2% ou inferior. Outra desvantagem deste método é que ele exige que o ar a ser exposta à fonte de UV durante um longo período de tempo, e qualquer ar que não está exposta à fonte de UV não serão tratadas. Isso faz com que os geradores UV impraticável para uso em situações que lidam com movendo rapidamente correntes de ar ou de água (in-duto de ar esterilização, por exemplo).
Plasma frio
No método de plasma frio, puro oxigénio do gás é exposta a um plasma criado por descarga de barreira dielétrica. O oxigênio diatômico é dividida em átomos individuais, que depois se recombinam em trigêmeos para formar ozônio.
Frio plasma máquinas utilizar oxigénio puro como a fonte de entrada, e produz uma concentração máxima de cerca de 5% de ozono. Eles produzem quantidades muito maiores de ozônio em um determinado espaço de tempo em comparação com a produção ultravioleta. No entanto, como geradores de ozônio de plasma frio são muito caros, e ainda necessitar de manutenção ocasional, eles são encontrados com menos freqüência do que os dois tipos anteriores.
As descargas manifestam como transferência filamentar de elétrons (micro descargas) em uma lacuna entre dois eletrodos. De modo a distribuir uniformemente as micro descargas, um dieléctrico isolante deve ser usado para separar os eléctrodos metálicos e para evitar formação de arco.
Algumas unidades de plasma frio também tem a capacidade de produzir allotropes de curta duração de oxigênio, que incluem O 4, O 5, O 6, O 7, etc. Estes ânions são ainda mais reativa do que O ordinária 3.
Considerações especiais
O ozono não podem ser armazenados e transportados como outros gases industriais (porque ele decai rapidamente em oxigénio diatómico) e deve, portanto, ser produzido no local. Geradores de ozônio disponíveis variam em concepção e ao arranjo dos eletrodos de alta tensão. Na maior capacidade de produção de 20 kg por hora, um tubo de gás / água permutador de calor é utilizado como eletrodo de aterramento e montados com eletrodos tubulares de alta tensão no lado do gás. O regime de pressões de gás típico é de cerca de 2 bar absoluta em oxigênio e 3 bar absoluto no ar . Vários megawatts de energia eléctrica podem ser instalados em grandes instalações, aplicado como uma fase CA corrente em 600-2000 Hz e pico tensões entre 3000 e 20000 volts.
O parâmetro dominante influenciar a eficiência de geração de ozono é a temperatura do gás, que é controlada pela temperatura da água de arrefecimento. O refrigerador da água, melhor a síntese de ozono. Nas condições industriais típicos, cerca de 90 por cento da energia eficaz é dissipada na forma de calor e tem de ser removido por um fluxo de água de arrefecimento suficiente.
Devido à elevada reactividade do ozono, a apenas alguns materiais pode ser utilizado como o aço inoxidável (316 L qualidade), vidro, politetrafluoretileno, ou fluoreto de polivinilideno. Viton pode ser usado com a restrição de forças mecânicas constantes e ausência de humidade.
Produção ao fundo
O ozono pode ser formado a partir de O 2 por descargas eléctricas e pela acção de alta energia de radiação electromagnética . Certo equipamento eléctrico gerar níveis significativos de ozono. Isto é especialmente verdadeiro para os dispositivos que utilizam altas tensões, tais como purificadores de ar iônicos, impressoras a laser, fotocopiadoras, e soldadores de arco. Motores elétricos que usam escovas pode gerar ozono a partir repetido faíscas no interior da unidade. Motores de grande porte que usam escovas, tais como os utilizados por elevadores ou bombas hidráulicas, irá gerar mais ozono do que os motores mais pequenos.
Produção Laboratório
No laboratório de ozono pode ser produzido por electrólise usando um Bateria de 9 volts, uma haste lápis grafite cátodo, uma platina de arame ânodo e um 3M de ácido sulfúrico electrólito. O reações metade celulares que ocorrem são
- 3 H2O → O 3 + 6 + 6 H + e -; AE S = -1,53 V ;
- 6 + 6 H + e - → 3 H 2; AE o = 0 V ;
- 2 H2O → O2 + 4H + + 4e -; AE S = -1,23 V ;
de modo que na reacção líquido três equivalentes de água são convertidos em um equivalente de ozono e de três equivalentes de hidrogénio . O oxigénio formação é uma reacção de competição.
Ele também pode ser preparado fazendo passar 10.000-20.000 volts DC O meio seco 2. Isto pode ser feito com um aparelho que consiste em dois tubos de vidro selados concêntricos juntos no topo, com entrada e saída e espigões na parte superior e na parte inferior do tubo exterior. O núcleo interno deve ter um comprimento de folha de metal inserida no mesmo ligado a um dos lados da fonte de energia. O outro lado da fonte de alimentação deve ser ligado a um outro pedaço de papel enrolado em torno do tubo externo. O seco 2 deve ser executado através do tubo em um espigão. Como o O 2 é executado através de uma torneira de dentro do aparelho e 10.000-20.000 volts DC são aplicadas aos condutores de folha, eletricidade descarrega entre o dioxygen seco no meio e forma O 3 em O 2 para fora o outro espigão. A reacção pode ser resumida da seguinte forma:
- 3 O 2 - eletricidade → 2 O 3
Aplicações
Aplicações industriais
Actualmente, os usos de ozônio como um produto químico industrial são um pouco limitadas. O maior uso de ozono está na preparação de produtos farmacêuticos, lubrificantes sintéticos, assim como muitas outras comercialmente úteis compostos orgânicos , onde é usado para cortar carbono - carbono títulos. Ele também pode ser usado para branqueamento de substâncias e para matar microorganismos em fontes de ar e água. Muitos sistemas de água potável municipais matar as bactérias com ozônio em vez do mais comum de cloro . O ozônio tem um muito elevado potencial de oxidação. O ozônio não forma compostos organoclorados, nem permanecer na água após o tratamento, de modo que alguns sistemas de introdução de uma pequena quantidade de cloro para impedir crescimento bacteriano nos tubos, ou pode usar cloro intermitentemente, com base em resultados de testes periódicos. Onde energia eléctrica é abundante, o ozono é um método eficaz em termos de custos de tratamento de água, como é produzido por encomenda e não requer o transporte e armazenamento de produtos químicos perigosos. Uma vez que tenha deteriorado, ele não deixa gosto ou odor na água potável. Os baixos níveis de ozono tenha sido anunciado para ser de alguma utilidade desinfetante em casas residenciais, no entanto, a concentração de ozônio obrigados a ter um efeito substancial sobre organismos patogênicos excede em muito os níveis de segurança recomendadas pela os EUA Segurança Ocupacional e Administração de Saúde e Agência de Proteção Ambiental.
Industrialmente, o ozônio é usado para:
- Desinfetar lavanderia em hospitais, fábricas de alimentos, cuidados casas etc;
- Desinfetante água no lugar de cloro
- Desodorizar o ar e objectos, tais como depois de um incêndio. Este processo é usado extensivamente em Restauração tecido;
- Matar bactérias em alimentos ou em superfícies de contacto;
- Piscina e spa Ozone saneamento
- Scrub levedura e bolor esporos do ar em plantas de processamento de alimentos;
- Lavar frutas e vegetais para matar fungos, mofo e bactérias frescas;
- Contaminantes ataque quimicamente em água ( ferro , arsénio , sulfeto de hidrogênio, nitritos e complexos orgânicos agrupados como "cor");
- Fornecer uma ajuda para floculação (aglomeração de moléculas, o que ajuda na filtração, em que o ferro e o arsénio são removidos);
- Fabricação compostos químicos através de síntese química
- Tecidos limpos e água sanitária (o antigo uso é utilizado em Tecido Restauração) (o último uso é patenteado);
- Ajudar no processamento de plásticos para permitir a adesão de tintas;
- Idade amostras de borracha para determinar a vida útil de um lote de borracha;
- Hospital quartos onde o ar tem de ser estéril operando;
- Erradicar transmitidas pela água, tais como parasitas Giardia e Cryptosporidium em estações de tratamento de água de superfície.
O ozono é um reagente em muitos reações orgânicas no laboratório e na indústria. A ozonólise é a clivagem de um alceno de compostos de carbonilo.
Muitos hospitais em os EUA e ao redor do mundo usam grandes geradores de ozônio para descontaminar salas de operação entre cirurgias. Os quartos são limpos e, em seguida, fechados hermeticamente antes de serem cheios com o ozônio que efetivamente mata ou neutraliza todas as bactérias restantes.
O ozono é utilizado como uma alternativa ao cloro ou dióxido de cloro na o branqueamento de polpa de madeira. Muitas vezes, é utilizado em conjunto com oxigénio e peróxido de hidrogénio para eliminar completamente a necessidade de compostos contendo cloro no fabrico de alta qualidade, branco papel
O ozono pode ser utilizado para desintoxicar resíduos de cianeto (por exemplo, de ouro e de prata mineração ) por oxidação de cianeto para cianato e, eventualmente, de dióxido de carbono .
Aplicações para o consumidor
Dispositivos que geram altos níveis de ozônio, alguns dos quais utilizam ionização, são utilizados para higienizar e desinfetar edifícios desabitados, quartos, canalização, woodsheds, e barcos e outros veículos.
Em os EUA, purificadores de ar que emitem baixos níveis de ozono foram vendidos. Este tipo de purificador de ar é reivindicado às vezes imitar a maneira da natureza de purificar o ar sem filtros e para higienizar tanto um como superfícies domésticas. O Agência de Proteção Ambiental dos Estados Unidos declarou que há "evidências que mostram que em concentrações que não excedam as normas de saúde pública, o ozônio não é eficaz na remoção de muitos causadoras de odor de produtos químicos" ou "vírus, bactérias, fungos, ou outros poluentes biológicos. " Além disso, o relatório afirma que "os resultados de alguns estudos controlados mostram que as concentrações de ozônio consideravelmente maior do que esses padrões [de segurança humana] são possíveis, mesmo quando um usuário segue as instruções de operação do fabricante." O governo processou uma empresa em 1995, ordenando-lhe que parar de repetir as alegações de saúde sem o apoio de estudos científicos.
Água ozonizada é utilizada para lavar roupas e para higienizar alimentos, água potável, e as superfícies em casa. De acordo com FDA, é "que altera o regulamentos de aditivos alimentares para fornecer para o uso seguro de ozono em fases gasosas e aquosas como um agente antimicrobiano em alimentos, incluindo carnes e aves. "Estudos na California Polytechnic University demonstrou que 0,3 níveis de ppm de ozono dissolvido na água da torneira filtrada pode produzir uma redução de mais de 99,99%, em tais microrganismos de origem alimentar como Salmonella, E. coli 0157: H7, e Campylobacter. O ozono pode ser usado para remover resíduos de pesticidas de frutas e legumes .
A nova tecnologia, patenteada usa ozônio para desinfetar e desodorizar equipamentos esportivos de proteção para o futebol, hóquei e lacrosse, soprando-lo diretamente no equipamento para destruir bactérias dentro do estofamento. Isto provou ser particularmente útil na luta contra a propagação do MRSA.
O ozônio é usado em spas e banheiras quentes para matar bactérias na água e para reduzir a quantidade de cloro ou de bromo necessária reactivando-os ao seu estado livre. Como o ozono não permanecer na água o tempo suficiente, por si só, o ozono não é eficaz na prevenção da contaminação cruzada entre os banhistas e deve ser usado em conjunto com esses átomos de halogénio. Ozono gasoso criado por luz ultravioleta ou por descarga de coroa é injectado na água.
O ozônio também é amplamente utilizado no tratamento de água em aquários e lagos com peixes. A sua utilização pode minimizar o crescimento de bactérias, parasitas de controlo, eliminar a transmissão de algumas doenças, e reduzir ou eliminar "amarelecimento" da água. O ozônio não deve entrar em contacto com estruturas de emalhar de peixe. Natural de água salgada (com formas de vida) fornece o suficiente "demanda instantânea" que quantidades controladas de ozônio ativar ião brometo de ácido hipobromoso, e o ozono decai totalmente em poucos segundos a minutos. Se ozono alimentado oxigênio é utilizado, a água será maior em oxigênio dissolvido, estruturas de emalhar de peixe irá atrofiar e eles se tornarão dependentes de níveis mais altos de oxigênio dissolvido. Os níveis de oxigênio dissolvido mais elevado tendem a minimizar o crescimento de algas.
Ozonoterapia
Terapia de ozono tem sido usado em medicina alternativa, como um tratamento médico, em um número de diferentes países. Sua base de evidência, no entanto tem sido questionada pela medicina ocidental.
Os Estados Unidos Food and Drug Administration (FDA) com base nos efeitos tóxicos conhecidos de ozônio e da falta de evidência científica de quaisquer efeitos benéficos em níveis não tóxicos, tem uma política estabelecida há muito tempo de que proíbe geradores de ozônio ou gás ozônio seja comercializado como um tratamento para qualquer terapia condições de ozônio médico é uma terapia alternativa e complementar bem estabelecida na maioria dos países europeus onde as autoridades de saúde têm tolerado a prática. A Cooperação Europeia das Sociedades de ozônio médicos, fundada em 1972 publica orientações sobre as indicações e contra-indicações médicas de ozônio e anfitriões de formação seminários.
Uma quantidade significativa de pesquisas tem nos últimos anos foram publicados em espreitar revistas de sociedades médicas internacionais que conficts com os pontos de vista do FDA avaliação. Aplicações médicas modernas de ozonização sangue fora do corpo, realizada pela Celacade e Eboo foram recentemente encontrados a terapia em ensaios clínicos para ser seguro e eficaz.
