
Nitrate
Contexte des écoles Wikipédia
SOS croit que l'éducation donne une meilleure chance dans la vie des enfants dans le monde en développement aussi. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Nitrate | |
|---|---|
 | |
 |  |
Nitrate | |
| Propriétés | |
| Formule moléculaire | NO - 3 |
| Masse molaire | 62,0049 g mol -1 |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
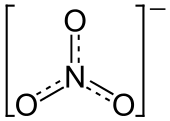
Le nitrate est un ion polyatomique avec la formule moléculaire est NO 3 - et une masse moléculaire de 62,0049 g / mol. Nitrates décrivent également l'organique groupe fonctionnel RONO 2. Ces esters nitrates sont une classe spécialisée d'explosifs.
Structure
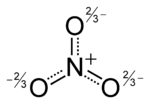
L'anion est de la la base conjuguée d' acide nitrique , constituée d'une centrale azote atome entouré de trois atomes d'oxygène liés de façon identique dans un agencement plan trigonal. L'ion nitrate porte un accusation formelle de -1. Ceci résulte d'une accusation formelle de combinaison dans laquelle chacun des trois oxygènes porte un - 2/3 accusation, alors que l'azote porte une charge 1, tous ces ajouter jusqu'à accusation formelle de l'ion de nitrate polyatomique. Cet agencement est communément utilisé comme un exemple de résonance. Comme le isoélectronique carbonate ions, l'ion nitrate peut être représenté par les structures de résonance:
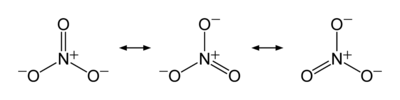
Propriétés
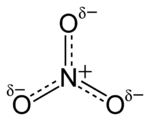
Presque tous les sels de nitrate inorganique sont solubles dans l'eau à température et pression normales. Un exemple commun d'un sel de nitrate inorganique est le nitrate de potassium (salpêtre).
Occurrence
Sels de nitrate se trouvent naturellement sur la terre comme de grands gisements, en particulier des Chili salpêtre une source majeure de nitrate de sodium.
Les nitrites sont produits par un certain nombre d'espèces de nitrifiantes bactéries, et les composés de nitrate pour la poudre (voir ce sujet pour plus) ont été produites historiquement, en l'absence de sources de nitrates minéraux, au moyen de diverses procédés de fermentation à l'aide de l'urine et les excréments.
Utilisations
Les nitrates sont produits principalement comme engrais dans l'agriculture en raison de leur grande solubilité et la biodégradabilité. Les principaux sont les nitrates d'ammonium, de sodium, de potassium, et les sels de calcium. Plusieurs millions de kilogrammes sont produits chaque année à cette fin.
D'autres utilisations
La deuxième application importante de nitrates comme agents oxydants, notamment en matière d'explosifs, où l'oxydation rapide de composés de carbone libère de grandes quantités de gaz (voir Gunpowder pour un exemple). Le nitrate de sodium est utilisé pour éliminer les bulles d'air à partir de verre fondu et certaines céramiques. Des mélanges de sel fondu sont utilisés pour durcir certains métaux.
Détection
Ions nitrate libre en solution peuvent être détectés par un nitrate électrode sélective d'ions. Ces électrodes analogue à l'électrode de pH sélective. Cette réponse est en partie décrit par la Équation de Nernst.
Toxicité
Toxicose
Nitrate intoxication peut se produire par métabolisme entéro-hépatique du nitrate en nitrite étant un intermédiaire. Nitrites oxyder les fer atomes dans hémoglobine à partir de ferreux fer (2+) à fer ferrique (3+), le rendant incapable de transporter l'oxygène. Ce processus peut conduire à généralisé le manque d'oxygène dans les tissus d'organes et une condition dangereuse appelée méthémoglobinémie. Bien que le nitrite est converti en ammoniac , se il ya plus de nitrite peut être converti, l'animal souffre d'un manque lentement de l'oxygène.
Effets sur la santé humaine
Les êtres humains sont soumis à la toxicité du nitrate, avec les nourrissons étant particulièrement vulnérables à la méthémoglobinémie due à métaboliser le nitrate triglycérides présents à des concentrations supérieures à d'autres stades de développement. Méthémoglobinémie chez les nourrissons est connu comme syndrome du bébé bleu. Bien que les nitrates dans l'eau potable ont été autrefois considérées comme un facteur contributif, il ya maintenant des doutes scientifiques importantes quant à savoir se il existe un lien de causalité. Le syndrome du bébé bleu est maintenant considérée comme le produit d'un certain nombre de facteurs, qui peuvent inclure tout facteur qui provoque des troubles gastriques, comme une infection diarrhéique, intolérance aux protéines, toxicité des métaux lourds, etc., avec des nitrates jouant un rôle mineur. Nitrates, si un facteur dans un cas particulier, serait le plus souvent être ingéré par les nourrissons dans l'eau potable élevée en nitrates. Toutefois, l'exposition du nitrate peut également se produire si l'alimentation, par exemple, les légumes contenant des niveaux élevés de nitrate. Laitue peut contenir élevés de nitrate dans des conditions de croissance tels que la lumière du soleil réduite, de la pénurie de molybdène micronutriments essentiels (Mo) et le fer (Fe), ou des concentrations élevées de nitrates en raison de l'assimilation réduite de nitrate dans l'usine. Des niveaux élevés de fertilisation azotée contribuent également à des niveaux élevés de nitrate dans la plante récoltée.
Certains adultes peuvent être plus sensibles aux effets de nitrate que d'autres. Le méthémoglobine réductase enzyme peut être sous-produit ou absents chez certaines personnes qui ont une mutation héréditaire. Ces personnes ne peuvent pas briser méthémoglobine aussi rapidement que ceux qui ont l'enzyme, conduisant à des taux circulants accrus de méthémoglobine (l'implication étant que leur sang ne est pas aussi riche en oxygène). Ceux avec de l'acide de l'estomac insuffisante (y compris certains végétariens et les végétaliens) peuvent également être à risque. Ce est l'augmentation de la consommation de légumes verts à feuilles qui accompagnent généralement ces types de régimes peuvent entraîner une augmentation de l'apport de nitrate. Une grande variété de conditions médicales, y compris les allergies alimentaires, l'asthme, l'hépatite et les calculs biliaires peuvent être liés à l'acide gastrique faible; ces personnes peuvent également être très sensibles aux effets de nitrate.
Méthémoglobinémie peut être traitée avec le bleu de méthylène, ce qui réduit le fer ferrique (3+) dans les globules affectées arrière en fer ferreux (2 +).
Toxicité Marine
En eau douce ou systèmes estuariens proches à la terre, le nitrate peuvent atteindre des niveaux élevés qui peuvent causer la mort des poissons. Bien que le nitrate est beaucoup moins toxique que l'ammoniac, des niveaux plus de 30 ppm de nitrate peut inhiber la croissance, altèrent le système immunitaire et provoquent un stress chez certaines espèces aquatiques. Toutefois, à la lumière des problèmes inhérents aux protocoles dernières sur expériences de toxicité aiguë de nitrate, la mesure de la toxicité des nitrates a été l'objet d'un débat récent.
Dans la plupart des cas, des concentrations de nitrates en excès dans les systèmes aquatiques, la principale source est ruissellement provenant agricoles ou de surface paysagers zones qui ont reçu des engrais de nitrate excès. Cela se appelle eutrophisation et peut conduire à la prolifération d'algues. En plus de diriger à l'eau anoxie et zones mortes, ces fleurs peuvent causer d'autres changements à fonction de l'écosystème, en favorisant certains groupes d'organismes sur les autres. En conséquence, comme le nitrate forme un composant de les solides dissous totaux, ils sont largement utilisés comme un indicateur de qualité de l'eau.
Le nitrate est également un sous-produit de fosses septiques. Pour être plus précis, ce est une substance chimique naturelle qui est à gauche après la rupture ou de la décomposition des déchets animaux ou humains. Qualité de l'eau peut également être affectée par des ressources d'eaux souterraines qui ont un grand nombre de systèmes septiques dans un bassin versant. Fosses septiques lixiviation vers le bas dans les ressources en eaux souterraines ou des aquifères et approvisionnement plans d'eau environnants. Lacs qui se appuient sur les eaux souterraines sont souvent affectées par la nitrification à travers ce processus.
Nitrate dans l'eau potable à des niveaux supérieurs à la norme nationale constitue une menace immédiate pour les jeunes enfants. Des niveaux excessifs peuvent entraîner une condition connue sous le nom " syndrome du bébé bleu ». Si non traitée, la maladie peut être fatale. Faire bouillir l'eau contaminée avec du nitrate augmente la concentration de nitrate et le risque potentiel.
Toxicité nitrates dans l'élevage
Intoxication par les nitrates est une préoccupation pour les producteurs de bovins essentiellement, mais aussi pour d'autres producteurs ruminants. Le nitrate est naturellement consommée par la culture de plantes; Toutefois, lorsque la croissance est interrompue, les racines des plantes continueront à prendre le nitrate du sol, et à moins que la nouvelle croissance des plantes se produit, le nitrate se accumulent. Ainsi, la récolte après les résultats de l'accumulation de nitrates dans une culture qui est riche en nitrates. Les facteurs qui peuvent causer une accumulation de nitrates dans les plantes sont le gel, la grêle, la sécheresse, les vents chauds et secs, les dégâts des pesticides, herbicides et dommages de toute autre plante rabougrissement des causes environnementales.
Les symptômes de l'empoisonnement par les nitrates comprennent une augmentation de la fréquence cardiaque et de la respiration; dans les cas avancés sang et les tissus peuvent prendre une couleur bleu ou brun. RSS peut être testé pour les nitrates; traitement consiste en complément ou en remplacement des fournitures existantes avec du matériel de nitrate inférieur. Les niveaux de sécurité de nitrate pour divers types de bétail sont les suivantes:
| Catégorie | NO 3% | % N-NO 3 | % KNO 3 | Effets |
|---|---|---|---|---|
| 1 | <0,5 | <0,12 | <0,81 | Généralement sans danger pour les bovins de boucherie et les moutons |
| 2 | 0,5-1,0 | 0,12 à 0,23 | 0,81 à 1,63 | Attention - certains symptômes subcliniques peut apparaître chez les chevaux, les moutons et les enceintes bovins de boucherie |
| 3 | 1.0 | 0,23 | 1,63 | Problèmes élevées de nitrates - les pertes de la mort et les avortements peuvent se produire chez les bovins et les moutons |
| 4 | <1,23 | <0,28 | <2,00 | Niveau de sécurité maximum pour les chevaux. Ne pas nourrir les fourrages élevés de nitrate à juments enceintes |
Les valeurs sont au-dessus sur un (humidité libre) base sèche.
Aperçu Nitrate
| HNO 3 | Il | |||||||||||||||||
| LiNO 3 | Soyez (NO 3) 2 | B (NO 3) 3 | C | N | O | Fa | Ne | |||||||||||
| NaNO 3 | Mg (NO 3) 2 | Al (NO 3) 3 | Si | P | S | ClONO 2 | Ar | |||||||||||
| KNO 3 | Ca (NO 3) 2 | Sc (NO 3) 3 | Ti | V | Cr (NO 3) 3 | Mn (NO 3) 2 | Fe (NO 3) 3 | Co (NO 3) 2 | Ni (NO 3) 2 | Cu (NO 3) 2 | Zn (NO 3) 2 | Géorgie | Ge | Comme | Se | Br | Kr | |
| RbNO 3 | Sr (NO 3) 2 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd (NO 3) 2 | AgNO 3 | Cd (NO 3) 2 | En | Sn | Sb | Te | CI | Xe | |
| CsNO 3 | Ba (NO 3) 2 | Hf | Ta | W | Ré | Os | Ir | Pt | Au | Hg (NO 3) 2 | Tl | Pb (NO 3) 2 | Bi | Po | À | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La | Ce | Pr | Dakota du Nord | Pm | Sm | Ue | Gd (NO 3) 3 | Tb | Dy | Ho | Er | Tm | YB | Lu | ||||
| Un C | Th | Pennsylvanie | UO 2 (NO 3) 2 | Np | Pu | Suis | Cm | Bk | Cf | Es | Fm | Md | Aucun | Lr | ||||
